 | |
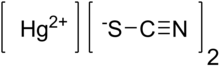 | |
| Имена | |
|---|---|
| Другие имена Тиоцианат ртути Сульфоцианат ртути | |
| Идентификаторы | |
| Количество CAS | |
| 3D модель ( JSmol ) | |
| ECHA InfoCard | 100,008,886 |
| Номер ЕС | |
| PubChem CID | |
| UNII | |
| Панель управления CompTox ( EPA) | |
ИнЧИ
| |
Улыбки
| |
| Характеристики | |
| Химическая формула | Hg (SCN) 2 |
| Молярная масса | 316,755 г / моль |
| Появление | Белый моноклинный порошок |
| Запах | без запаха |
| Плотность | 3,71 г / см 3, твердый |
| Температура плавления | 165 ° С (329 ° F, 438 К) (разлагается) |
| Растворимость в воде | 0,069 г / 100 мл |
| Растворимость | Растворим в разбавленной соляной кислоте, KCN, аммиаке, слабо растворим в спирте, эфире |
| Магнитная восприимчивость (χ) | -96,5 10 -6 см 3 / моль |
| Опасности | |
| Основные опасности | высокотоксичный |
| Классификация ЕС (DSD) (устарела) | |
| NFPA 704 (огненный алмаз) |  3 1 1 3 1 1 |
| Смертельная доза или концентрация (LD, LC): | |
| LD 50 ( средняя доза ) | 46 мг / кг (крыса, перорально) |
| Если не указано иное, данные приведены для материалов в их стандартном состоянии (при 25 ° C [77 ° F], 100 кПа). | |
| | |
| Ссылки на инфобоксы | |
Тиоцианат ртути (II) (Hg (SCN) 2) - неорганическое химическое соединение, координационный комплекс Hg 2+ и тиоцианат- аниона. Это белый порошок. При воспламенении он производит большую извилистую «змею» - эффект, известный как змея фараона.
Первый синтез тиоцианата ртути, вероятно, был завершен в 1821 году Йенсом Якобом Берцелиусом :
Доказательства первого чистого образца были представлены в 1866 году химиком Отто Гермесом. Его получают обработкой растворов, содержащих ионы ртути (II) и тиоцианата. Продукт с низкой растворимостью тиоцианата ртути вызывает его осаждение из раствора. Большинство синтезов достигается осаждением:
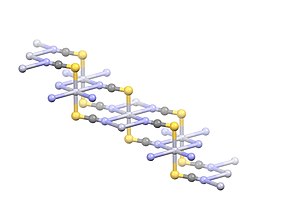
Соединение имеет полимерную структуру с центрами Hg 2+, линейно координированными с двумя атомами S на расстоянии 2,381 Å. Указаны четыре слабых взаимодействия Hg 2+ -N с расстояниями 2,81 Å.
Тиоцианат ртути имеет несколько применений в химическом синтезе. Это предшественник трис (тиоцианато) меркурата (II) (K [Hg (SCN) 3 ]) калия и трис (тиоцианато) меркурата (II) цезия (Cs [Hg (SCN) 3 ]). Ион Hg (SCN) 3 - также может существовать независимо и легко образуется, среди прочего, из вышеперечисленных соединений.
Его реакции с органическими галогенидами дают два продукта: один с серой, связанной с органическим соединением, и один с азотом, связанным с органическим соединением.
Было обнаружено, что тиоцианат ртути может улучшить пределы обнаружения при определении хлорид-ионов в воде с помощью УФ-видимой спектроскопии. Этот метод был впервые предложен в 1952 году и с тех пор является обычным методом определения хлорид-ионов в лабораториях по всему миру. Автоматическая система была изобретена в 1964 году, а затем в 1974 году компания Technicon ( Тарритаун, Нью-Йорк, США) выпустила коммерческий анализатор цвета. Основной механизм включает добавление тиоцианата ртути к раствору с неизвестной концентрацией хлорид-ионов и железа в качестве реагента. Ионы хлора вызывают диссоциацию тиоцианатной соли ртути и связывание тиоцианат-иона Fe (III), которое интенсивно поглощается при длине волны 450 нм. Это поглощение позволяет измерить концентрацию комплекса железа. Это значение позволяет рассчитать концентрацию хлорида.
Его можно использовать для определения концентрации хлорид-ионов в водном растворе. Тиоцианат ртути без железа (III) добавляют к раствору с неизвестной концентрацией хлорид-ионов, образуя комплекс тиоцианата ртути и иона хлорида, который поглощает свет с длиной волны 254 нм, что позволяет более точно измерять концентрацию, чем вышеупомянутый метод с использованием железо.
 Демонстрация змея фараона
Демонстрация змея фараона Раньше тиоцианат ртути использовался в пиротехнике, вызывая эффект, известный как змея фараона или змея фараона. Когда соединение находится в присутствии достаточно сильного источника тепла, начинается быстрая экзотермическая реакция, которая приводит к образованию большой массы спиралевидного твердого вещества, напоминающего змею. Незаметное пламя, часто синее, но также может быть желто-оранжевым, сопровождает горение. Получающееся в результате твердое вещество может иметь цвет от темно-серого графита до светло-коричневого, причем внутренняя часть обычно намного темнее, чем внешняя часть.
Реакция состоит из нескольких стадий: воспламенение тиоцианата ртути приводит к образованию нерастворимой коричневой массы, которая в основном представляет собой нитрид углерода C 3 N 4. Также производятся сульфид ртути и сероуглерод.