| Синтез пиррола Кнорра | |
|---|---|
| Назван в честь | Людвига Кнорра |
| Тип реакции | Реакция образования кольца |
| Идентификаторы | |
| RSC ID онтологии | RXNO: 0000497 |
Синтез пиррола Кнорра - широко используемая химическая реакция, который синтезирует замещенные пирролы (3) . Метод включает реакцию α- амино - кетона (1) и соединения, содержащего электроноакцепторную группу (например, сложный эфир, как показано) α с карбонильной группой (2) .

Механизм требует цинка и уксусной кислоты в качестве катализаторов. Это будет продолжаться при комнатной температуре. Поскольку α-амино-кетоны очень легко самоконденсируются, их необходимо получать на месте. Обычный способ сделать это - из соответствующего оксима через перегруппировку Небера.
В исходном синтезе Кнорра использовались два эквивалента этилацетоацетата, один из которых был преобразован в этил-2-оксиминоацетоацетат, растворяя его в ледяной уксусной кислоте и медленно добавляя один эквивалент насыщенного водного нитрита натрия при внешнем охлаждении. Цинковую пыль затем примешивали, восстанавливая оксимную группу до амина. Это восстановление потребляет два эквивалента цинка и четыре эквивалента уксусной кислоты.
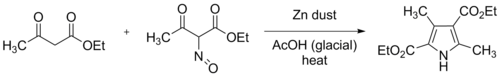
Современная практика заключается в постепенном добавлении раствора оксима, образующегося в результате нитрозирования, и цинковой пыли к хорошо перемешанному раствору этилацетоацетата в ледяной уксусной кислоте. Реакция экзотермическая, и смесь может достичь точки кипения, если не применять внешнее охлаждение. Полученный продукт, диэтил-3,5-диметилпиррол-2,4-дикарбоксилат, с тех пор называется пирролом Кнорра . На схеме выше R 2 = COOEt и R 1 = R 3 = Me представляют эту исходную реакцию.
Пиррол Кнорра можно преобразовать в производные различными способами. Один эквивалент гидроксида натрия будет селективно омылять 2-эфир. Растворение пиррола Кнорра в концентрированной серной кислоте с последующим выливанием полученного раствора в воду селективно гидролизует 4-сложноэфирную группу. 5-Метильная группа может быть по-разному окислена до функциональности хлорметила, альдегида или карбоновой кислоты при использовании стехиометрического сульфурилхлорида в ледяной уксусной кислоте. Альтернативно атом азота может быть алкилирован. Два сложноэфирных положения можно более плавно дифференцировать путем включения бензил или трет-бутил групп через соответствующие ацетоацетатные эфиры. Бензильные группы можно удалить каталитическим гидрогенолизом над палладием на угле, а трет-бутильные группы можно удалить обработкой трифторуксусной кислотой или кипячением водной уксусной кислоты.. R 1 и R 3 (а также R 2 и «Et») можно варьировать путем применения соответствующих β-кетоэфиров, легко получаемых путем синтеза. происходит из хлорангидридов, кислоты Мелдрама и спирта по выбору. Сложные этиловые и бензиловые эфиры легко получить, и эта реакция примечательна тем, что даже сильно затрудненный трет-бутиловый спирт дает очень высокие выходы в этом синтезе.
Леви и Занетти расширили диапазон Knorr. синтез в 1894 г. с использованием ацетилацетона (2,4-пентандиона) в реакции с этил-2-оксиминоацетоацетатом. Результатом был этил-4-ацетил-3,5-диметилпиррол-2-карбоксилат, где «OEt» = R 1 = R 3 = Me, и R 2 = COOEt. 4-ацетильная группа может быть легко преобразована в 4-этильную группу посредством восстановления Вольфа-Кишнера (гидразин и щелочь, нагретые); гидрогенолиз или использование диборана. Бензил или трет-бутилацетоацетаты также хорошо работают в этой системе, а при строгом контроле температуры трет-бутиловая система дает очень высокий выход (около 80%). N, N-диалкилпиррол-2- и / или 4-карбоксамиды могут быть получены с использованием N, N-диалкилацетоацетамидов в синтезе. С помощью этого метода были успешно получены даже тиоэфиры. Что касается нитрозирования β-кетоэфиров, несмотря на многочисленные спецификации в литературе о строгом контроле температуры при нитрозировании, реакция ведет себя почти как титрование, и смеси можно позволить достичь даже 40 ° C без значительного влияния на конечный выход.
Механизм синтеза пиррола Кнорра начинается с конденсации амина и кетона с образованием имина. Затем имин таутомеризуется до енамина с последующей циклизацией, удалением воды и изомеризацией в пиррол.

Существует ряд важных синтезов пирролов, которые осуществляются по методике синтеза Кнорра, несмотря на наличие очень разных механизмов связи между исходными материалами и пиррольным продуктом.
Ганс Фишер и Эмми Финк обнаружили, что синтез Занетти из 2,4-пентандиона и этил-2-оксиминоацетоацетата дает этил-3,5-диметилпиррол-2-карбоксилат в качестве побочного продукта в следовых количествах. Аналогичным образом, диэтилацеталь 3-кетобутиральдегида приводил к образованию этил-5-метилпиррол-2-карбоксилата. Оба этих продукта возникли в результате потери ацетильной группы предполагаемого промежуточного этил-2-аминоацетоацетата. Важным продуктом синтеза Фишера-Финка был этил-4,5-диметилпиррол-2-карбоксилат, полученный из этил-2-оксиминоацетоацетата и 2-метил-3-оксобутаналя, в свою очередь полученный конденсацией Клайзена 2-бутанон с этилформиатом.
Джордж Кляйнспен сообщил, что связь Фишера-Финка может быть вызвана исключительно использованием диэтилоксиминомалоната в синтезе с 2,4-пентандионом, или его 3-алкилзамещенные производные. Урожайность была высокой, около 60%, и этот синтез в конечном итоге стал одним из самых важных в репертуаре. Выходы были значительно улучшены за счет использования предварительно полученного диэтиламиномалоната (полученного гидрогенолизом диэтилоксиминомалоната в этаноле над Pd / C) и добавления смеси диэтиламиномалоната и β-дикетона к активно кипящей ледяной уксусной кислоте.
Между тем, Джонсон расширил синтез Фишера-Финка за счет взаимодействия эфиров 2-оксиминоацетоацетата (этилового, бензилового или трет-бутилового) с 3-алкилзамещенными 2,4-пентандионами. Синтез Кляйнспена был расширен под руководством Дэвида Дельфина за счет использования несимметричных β-дикетонов (таких как 3-алкилзамещенные 2,4-гександионы), которые вначале предпочтительно реагировали с менее затрудненной ацетильной группой и давали соответствующую 5-метилпиррол-2-карбоксилатные эфиры. Было обнаружено, что N, N-диалкил-2-оксиминоацетоацетамиды также дают пирролы при взаимодействии в условиях Кнорра с 3-замещенными-2,4-пентандионами с выходами, сравнимыми с выходами соответствующих сложных эфиров (около 45%). Однако при использовании несимметричных дикетонов было обнаружено, что ацетильная группа из ацетоацетамида сохраняется в продукте, а одна из ацильных групп из дикетона теряется. Этот же механизм в незначительной степени встречается в системах эфиров ацетоацетата и ранее был обнаружен радиохимически Харбаком и Рапопортом. Большинство описанных выше синтезов находят применение в синтезе порфиринов, желчных пигментов и дипирринов.