 Семейство адгезионных GPCR . Члены определяются их необычной гибридной структурой, в которой большая внеклеточная область, часто содержащая известные белковые модули, соединена с семичастной трансмембранной областью через домен (GAIN), индуцирующий GPCR-Autoproteolsis.
Семейство адгезионных GPCR . Члены определяются их необычной гибридной структурой, в которой большая внеклеточная область, часто содержащая известные белковые модули, соединена с семичастной трансмембранной областью через домен (GAIN), индуцирующий GPCR-Autoproteolsis. Адгезия G-белковые рецепторы (GPCR адгезии ) представляют собой класс из 33 человеческих белковых рецепторов с широким распределением в эмбриональных и личиночных клетках, клетках репродуктивного тракта, нейронах, лейкоцитах и разнообразные опухоли. Адгезионные GPCR обнаруживаются повсюду в многоклеточных животных, а также в одноклеточных колониях, образующих хоанофлагелляты, таких как Monosiga brevicollis, и одноклеточных организмах, таких как Filasterea. Определяющей особенностью адгезионных GPCR, которая отличает их от других GPCR, является их гибридная молекулярная структура. Внеклеточная область адгезионных GPCR может быть исключительно длинной и содержать множество структурных доменов, которые известны своей способностью способствовать взаимодействию клеток и матрикса. Их внеклеточная область содержит проксимальный мембранный домен GAIN (GPCR-Autoproteolsis INiding). Кристаллографические и экспериментальные данные показали, что этот структурно консервативный домен опосредует автокаталитический процессинг в GPCR-протеолитическом сайте (GPS) проксимальнее первой трансмембранной спирали. Автокаталитический процессинг приводит к появлению внеклеточной (α) и трансмембранной (β) субъединицы, которые связаны нековалентно, что приводит к экспрессии гетеродимерного рецептора на поверхности клетки. Профили лигандов и исследования in vitro показали роль адгезионных GPCR в адгезии и миграции клеток. Работа с использованием генетических моделей ограничила эту концепцию, продемонстрировав, что основная функция адгезионных GPCRs может относиться к правильному расположению клеток в различных системах органов. Более того, все больше доказательств указывает на роль адгезионных GPCR в метастазировании опухолевых клеток. Формальная передача сигнала, связанная с G-белком, была продемонстрирована для ряда адгезионных GPCR, однако статус орфанного рецептора многих рецепторов по-прежнему затрудняет полную характеристику потенциальных путей передачи сигнала. В 2011 году был создан консорциум adhesion GPCR для облегчения исследования физиологических и патологических функций адгезионных GPCR.
Суперсемейство GPCR - это самое большое семейство генов в геноме человека, содержащее примерно 800 гены. Поскольку надсемейство позвоночных можно филогенетически сгруппировать в пять основных семейств, была предложена система классификации GRAFS, которая включала глутамат, родопсин, адгезию , Frizzled / Taste2 и Secretin семейства GPCR.
Существует 33 адгезионных GPCR человека, которые можно разделить на 8 группы и 2 независимых рецептора. Группа I состоит из LPHN1, LPHN2, LPHN3 и ETL. Группа II состоит из CD97, EMR1, EMR2, EMR3 и EMR4. Группа III состоит из GPR123, GPR124 и GPR125. Группа IV состоит из CELSR1, CELSR2 и CELSR3. Группа V состоит из GPR133 и GPR144. Группа VI состоит из GPR110, GPR111, GPR113, GPR115 и GPR116. Группа VII состоит из BAI1, BAI2 и BAI3. Группа VIII состоит из GPR56, GPR97, GPR112, GPR114, GPR126 и GPR64. Два дополнительных адгезионных GPCR не попадают в эти группы: VLGR1 и GPR128.
Адгезионные GPCR обнаружены у грибов. Считается, что они произошли от семейства рецепторов цАМФ, возникшего примерно 1275 миллионов лет назад, до отделения униконтов от общего предка. Некоторые грибы имеют новые адгезионные GPCR, которые имеют как короткие, 2–66 аминокислотных остатков, так и длинные, 312–4202 аминокислотных остатка. Анализ грибов показал отсутствие GPCR семейства секретиновых рецепторов, что позволяет предположить, что они произошли от адгезионных GPCR в более позднем организме.
Анализ генома Teleost Takifugu rubripes обнаружил, что он имеет только два адгезионных GPCR, которые показали гомологию с Ig-гепта / GPR116. В то время как геном Fugu относительно компактен и ограничен числом адгезионных GPCR, Tetraodon nigroviridis, другой вид рыбы фугу, имеет значительно больше, всего 29 адгезионные GPCR.
Большинство адгезионных GPCR являются рецепторами-сиротами, и ведется работа по де-сиротству многих из этих рецепторов. Адгезионные GPCR получили свое название от своих N-концевых доменов, которые имеют подобные адгезии домены, такие как EGF, и веры в то, что они взаимодействуют с клеткой и клеткой и внеклеточным матриксом. Хотя лиганды для многих рецепторов все еще неизвестны, исследователи используют библиотеки лекарств для исследования соединений, которые могут активировать GPCR, и используют эти данные для будущих исследований лигандов.
Один адгезионный GPCR, GPR56, имеет известный лиганд, коллаген III, который участвует в ингибировании миграции нейронов. GPR56 был показан быть причиной полимикрогирии у людей и может играть роль в развитии рака метастазов. Связывание коллагена III с GPR56 происходит на N-конце и сужается до короткого отрезка аминокислот. N-конец GPR56 в природе гликозилирован, но это гликозилирование не является необходимым для связывания коллагена III. Коллаген III приводит к тому, что GPR56 передает сигнал через Gα12 / 13, активируя RhoA.
Адгезионные GPCR, по-видимому, способны следовать стандартным режимам передачи сигналов GPCR и сигнал через Gαs, Gαq, Gαi и Gα12 / 13. На сегодняшний день многие из адгезионных GPCR все еще являются рецепторами-сиротами, и их сигнальные пути не идентифицированы. Исследовательские группы работают над выяснением нижестоящих сигнальных молекул, используя несколько методов, включая химический скрининг и анализ уровней вторичных мессенджеров в сверхэкспрессированных клетках. Добавление лекарств in vitro, в то время как клетки чрезмерно экспрессируют адгезионную GPCR, позволило идентифицировать молекулы, активирующие GPCR, и используемые вторичные посредники.
GPR133 передает сигналы через Gαs на активируют аденилилциклазу. Было показано, что избыточная экспрессия GPCR in vitro может приводить к активации рецептора в отсутствие лиганда или агониста. При чрезмерной экспрессии GPR133 in vitro наблюдалось повышение репортерных генов и цАМФ. Передача сигналов сверхэкспрессированного GPR133 не требовала N-конца или расщепления GPS. Миссенс-мутации в области 7TM привели к потере передачи сигналов.
Гомолог латрофилина LPHN1 был показан в C. elegans требовать GPS для передачи сигналов, но расщепление на сайте GPS не было необходимо. Более того, наличие укороченного трансмембранного домена 7, но с интактным доменом GPS, привело к потере передачи сигналов. Это предполагает, что наличие интактных трансмембранных доменов GPS и 7 участвует в передаче сигналов и что сайт GPS может действовать как или быть необходимой частью эндогенного лиганда.
GPR56, как было показано, расщепляется на участке GPS и затем остается связанным с доменом 7TM. В исследовании, в котором N-конец был удален до N342 (начало GPS), рецептор стал конститутивно активным и наблюдалась повышающая регуляция Gα12 / 13. Когда рецепторы активны, они убиквитинируются, а GPR56, лишенный N-конца, очень убиквитинирован.
Многие адгезионные GPCR подвергаются протеолитическим событиям посттрансляционно в высококонсервативных Cys-богатых мотивах, известных как сайты протеолиза GPCR (GPS), которые расположены рядом с первой трансмембранной областью. Этот сайт называется сайтом HL-S (T). Как только этот белок расщепляется, части экспрессируются на поверхности клетки как гетеродимер. Считается, что это расщепление происходит внутри самого белка через консервативный домен GAIN. Этот процесс, по-видимому, аналогичен процессам, обнаруженным в других аутопротеолитических белках, таких как гидролазы Ntn и белки hedgehog.
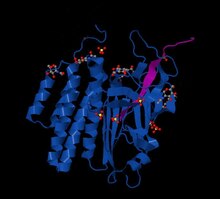 GPCR-автопротеолиз, индуцирующий (GAIN) домен , латрофилин крысы 4DLQ опосредует автокаталитическое расщепление адгезионных GPCR
GPCR-автопротеолиз, индуцирующий (GAIN) домен , латрофилин крысы 4DLQ опосредует автокаталитическое расщепление адгезионных GPCR Одна характеристика адгезионные GPCR - это их расширенная внеклеточная область. Эта область имеет модульную природу, часто имеет множество структурно определенных белковых доменов и проксимальный мембранный домен GAIN. В хорошо названном очень большом G-белке рецепторе 1 VLGR1 внеклеточная область простирается почти до 6000 аминокислот. Адгезионные GPCR человека содержат домены, включая EGF- подобные (Pfam PF00053 ), кадгерин (Pfam PF00028 ), тромбоспондин (Pfam PF00090 ), Иммуноглобулин (Pfam PF00047 ), пентраксин (Pfam PF00354 ), (Pfam PF03160 ) и лейцин- богатые повторы (Pfam PF00560 ). У беспозвоночных видов множество других структурных мотивов, включая Kringle, Somatomedin B (Pfam PF01033 ), SRCR (Pfam PF00530 ) может содержаться во внеклеточной области. Поскольку было продемонстрировано, что многие из этих доменов опосредуют белок-белковые взаимодействия внутри других белков, считается, что они играют ту же роль в адгезионных GPCR. В самом деле, многие лиганды были обнаружены для адгезионных GPCR (см. Раздел о лигандах). Многие из адгезионных GPCR обладают длинными участками аминокислот с низкой гомологией с известными белковыми доменами, что позволяет предположить возможность выявления новых структурных доменов внутри их внеклеточных областей.
Ряд адгезионных GPCR могут играть важную роль в иммунной системе. В частности, члены подсемейства EGF-TM7, которые обладают N-концевыми EGF-подобными доменами, преимущественно ограничены лейкоцитами, что указывает на предполагаемую роль в иммунной функции. Семейство EGF ‑ TM7 человека состоит из CD97, EMR1 (ортолог рецептора F4 / 80), EMR2, EMR3 и EMR4 (вероятный псевдоген у человека). Рецептор EMR2, ограниченный человеком, экспрессируется миелоидными клетками, включая моноциты, дендритные клетки и нейтрофилы, которые, как было показано, участвуют в активации и миграции человека. нейтрофилов и повышенная регуляция у пациентов, страдающих синдромом системного воспалительного ответа (SIRS). Требуется подробная информация о EMR1, CD97. Ингибитор 1 адгезии-GPCR ангиогенеза головного мозга (BAI1) действует как рецептор фосфатидилсерина, играющий потенциальную роль в связывании и удалении апоптотических клеток, а также в фагоцитозе грамотрицательных бактерий. Было показано, что GPR56 является маркером субпопуляций воспалительных клеток NK и экспрессируется цитотоксическими лимфоцитами.
GPR126 необходимо для шванновских клеток миелинизация. Нокауты этого адгезионного GPCR как в Danio rerio, так и в Mus musculus приводят к остановке на стадии промиелинизации. Шванновские клетки возникают из нервного гребня, который мигрирует к периферическим нервам с образованием миелинизирующих или немиелинизирующих клеток. При нокауте GPR126 эти клетки-предшественники развиваются до стадии промиелинизации, на которой они обертываются примерно в 1,5 раза. Миелинизация останавливается на стадии промиелинизации, и у рыб не может быть обнаружен основной белок миелина. У рыб это можно исправить, добавив форсколин во время развития, который устраняет экспрессию основного белка миелина.
GPR56 могут играть роль в взаимодействия между костным мозгом и гемопоэтическими стволовыми клетками.
Мутации с потерей функции были показаны в ряде адгезионных GPCR, включая GPR56, GPR126 и VLRG1. Многие мутации влияют на функцию через снижение экспрессии на клеточной поверхности или ингибирование автопротеолиза в домене GAIN. Мутации в GPR56 приводят к двусторонней лобно-теменной полимикрогирии у людей, характеризующейся аномальной миграцией нейронов и поверхностными эктопиями. Варианты GPR126 были связаны с подростковым идиопатическим сколиозом, а также ответственны за тяжелый артрогрипоз множественный врожденный. Было показано, что усиление функциональных мутаций в домене GAIN в EMR2 приводит к чрезмерной дегрануляции тучными клетками, что приводит к вибрационной крапивнице.