| Т-образная геометрия молекулы | |
|---|---|
 | |
| Примеры | ClF 3 |
| Точечная группа | C2v |
| Координационное число | 3 |
| Угол (а) связи | 90 °, 180 ° |
| μ ( Полярность) | >0 |
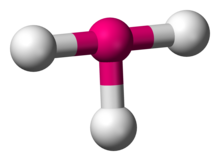
 Структура трифторида хлора, примера соединения с Т-образной координационной геометрией.
Структура трифторида хлора, примера соединения с Т-образной координационной геометрией. В химии Т-образная молекулярная геометрия описывает структуры некоторых молекулы, у которых центральный атом имеет три лиганда. Обычно трехкоординированные соединения принимают плоскую тригональную или пирамидальную геометрию. Примерами Т-образных молекул являются трифториды галогенов, такие как ClF 3.
Согласно теории VSEPR, Т-образная геометрия получается, когда три лиганда и две неподеленные пары электронов связаны с центральным атом, записанный в нотации AX как AX 3E2. Т-образная геометрия связана с тригонально-бипирамидной геометрией молекул AX 5 с тремя экваториальными и двумя аксиальными лигандами. В молекуле AX 3E2две неподеленные пары занимают две экваториальные позиции, а три атома лиганда занимают две аксиальные позиции, а также одну экваториальную позицию. Три атома связываются под углами 90 ° на одной стороне центрального атома, образуя Т-образную форму.
Трифтороксенат (II) анион, XeF. 3, был исследован как возможный первый пример AX 3E3молекула, которая, как можно было бы ожидать, исходя из соображений VSEPR, будет иметь шесть электронных пар в октаэдрическом расположении как с тремя неподеленными парами, так и с тремя лигандами в мер или Т-образной форме. ориентации. Хотя этот анион был обнаружен в газовой фазе, попытки синтеза в растворе и экспериментального определения структуры были безуспешными. Исследование компьютерной химии показало искаженную плоскую Y-образную геометрию с наименьшим валентным углом F – Xe – F, равным 69 °, а не 90 °, как в T-образной геометрии.