Радикалы в химии определяются как реактивные атомы или молекулы, содержащие неспаренные электроны в открытой оболочке. Непарные электроны заставляют радикалы быть нестабильными и реактивными. Реакции в радикальной химии могут приводить как к радикальным, так и нерадикальным продуктам. Радикальное диспропорционирование включает группу реакций в органической химии, в которых два радикала реагируют с образованием двух разных нерадикальных продуктов. Эти реакции могут происходить со многими радикалами в растворе и в газовой фазе. Из-за нестабильной природы радикальных молекул диспропорционирование происходит быстро и требует незначительной энергии активации. Наиболее тщательно изученные реакции радикального диспропорционирования были проведены с радикалами алкил, но есть много органических молекул, которые могут проявлять более сложные многоступенчатые реакции диспропорционирования.
В реакциях радикального диспропорционирования одна молекула действует как акцептор, а другая - как донор. В наиболее распространенных реакциях диспропорционирования атом водорода отбирается или отводится акцептором, когда молекула-донор подвергается реакции элиминирования с образованием двойной связи. Другие атомы, такие как галогены, также могут быть отщеплены во время реакции диспропорционирования. Отрыв происходит как реакция голова к хвосту с атомом, который отрывается, обращенным к радикальному атому на другой молекуле.

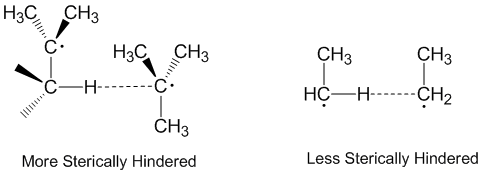
Радикальное диспропорционирование часто рассматривается как происходящее линейно, когда донорный радикал, акцепторный радикал и атом принимаются вдоль одной и той же оси. Фактически, большинство реакций диспропорционирования не требуют линейной ориентации в пространстве. Молекулы с более пространственными затруднениями требуют более линейного расположения и, следовательно, реагируют медленнее. Стерические эффекты играют значительную роль в диспропорционировании с этильными радикалами, действующими как более эффективные акцепторы, чем трет-бутил радикалы. У трет-бутильных радикалов есть много атомов водорода на соседних атомах углерода, которые они могут отдавать, и стерические эффекты часто предотвращают приближение трет-бутильных радикалов к отвлечению водородов.
Диспропорционирование алкильных радикалов широко изучалось в научной литературе. Во время диспропорционирования алкильных радикалов алкан и алкен являются конечными продуктами, и порядок связи продуктов увеличивается на единицу по сравнению с реагентами. Таким образом, реакция является экзотермической (ΔH = 50-95 ккал / моль) и протекает быстро.
Перекрестное диспропорционирование происходит, когда два разных алкильных радикала диспропорционируют с образованием двух новых продуктов. В зависимости от этого могут образовываться разные продукты. от какого алкильного радикала действует как донор, а какой - как акцептор. Эффективность первичных и вторичных алкильных радикалов как доноров зависит от стерических эффектов и конфигурации акцепторов радикалов.
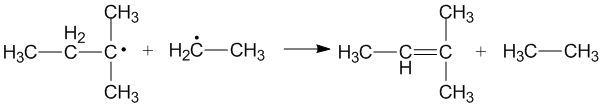
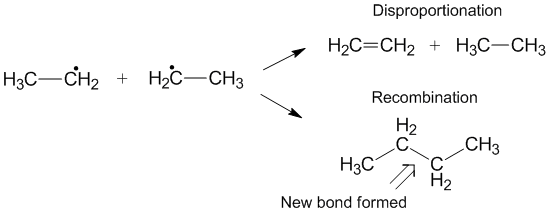
Другой реакция, которая иногда может происходить вместо диспропорционирования, сочетание. Во время рекомбинации два радикала образуют один новый нерадикальный продукт и одну новую связь. Подобно диспропорционированию, реакция рекомбинации экзотермична и не требует энергии активации. Отношение скоростей диспропорционирования к рекомбинации обозначается как k D/kCи часто способствует рекомбинации по сравнению с диспропорционированием для алкильных радикалов. По мере увеличения количества переносимых атомов водорода константа скорости для диспропорционирования увеличивается по сравнению с константой скорости для рекомбинации.
Когда атомы водорода в алкильный радикал замещается дейтерием, диспропорционирование протекает с несколько меньшей скоростью, тогда как скорость рекомбинации остается той же. Таким образом, на диспропорционирование слабо влияет кинетический изотопный эффект с k H/kD= 1,20 ± 0,15 для этилена. Водороды и дейтроны не участвуют в реакциях рекомбинации. Однако отрыв дейтрона во время диспропорционирования происходит медленнее, чем отвод водорода из-за увеличенной массы и уменьшенной колебательной энергии дейтерия, хотя экспериментально наблюдаемое k H/kDблизко к единице.
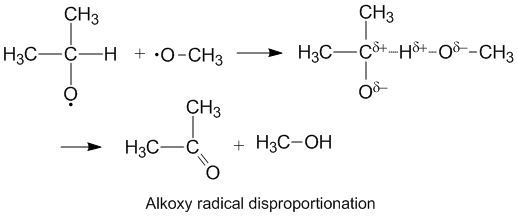
Алкокси радикалы, которые содержат неспаренные электроны на атоме кислорода, имеют более высокий k D/kCпо сравнению с алкильными радикалами. Кислород имеет частичный отрицательный заряд, который снижает электронную плотность у донорного атома углерода, тем самым облегчая отвод водорода. Скорости диспропорционирования также способствует более электроотрицательный кислород на молекуле акцептора.
Многие радикальные процессы включают цепные реакции или цепные распространение с диспропорционированием и рекомбинацией, происходящими на конечной стадии реакции. Прерывание роста цепи часто является наиболее важным во время полимеризации, поскольку желаемое распространение цепи не может иметь место, если легко протекают реакции диспропорционирования и рекомбинации. Контроль продуктов обрыва и регулирование реакций диспропорционирования и рекомбинации на конечной стадии являются важными аспектами радикальной химии и полимеризации. В некоторых реакциях (таких как показанная ниже) один или оба пути обрыва могут быть затруднены стерическими эффектами или действием растворителя.
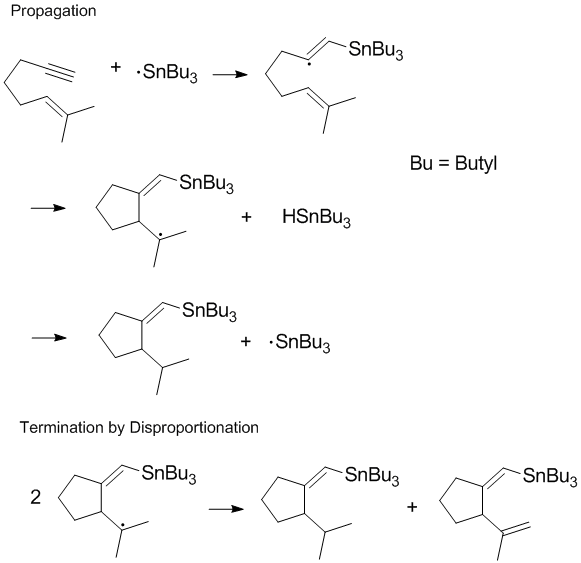
Многие химики-полимеры обеспокоены с ограничением скорости диспропорционирования при полимеризации. Хотя диспропорционирование приводит к образованию одной новой двойной связи, которая может реагировать с полимерной цепью, также образуется насыщенный углеводород, и поэтому цепная реакция протекает нелегко. Во время свободнорадикальной полимеризации пути обрыва растущей полимерной цепи удаляются. Этого можно добиться несколькими способами, один из которых - обратимое обрывание стабильными радикалами. Нитроксид радикалы и другие стабильные радикалы снижают скорость рекомбинации и диспропорционирования и контролируют концентрацию полимерных радикалов.
