
 Аммиак, фосфин и арсин, три простых гидрида пниктогена
Аммиак, фосфин и арсин, три простых гидрида пниктогена Гидриды пниктогена или пниктиды водорода являются бинарными соединениями водород с атомами пниктогена (элементы группы 15: азот, фосфор, мышьяк, сурьма и висмут ), ковалентно связанный с водородом.
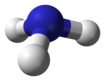
Самый простой ряд имеет химическую формулу XH 3 (реже H 3 X), где X представляет любой из пниктогены. Они принимают пирамидальную структуру (в отличие от планарного тригонального расположения гидридов группы 13 ) и поэтому являются полярными. Эти тригидриды пниктогена обычно становятся все более нестабильными и ядовитыми по отношению к более тяжелым элементам.
Подобно простым галогенидам водорода и халькогенидам, гидриды пниктогенов являются водорастворимыми - растворимыми. В отличие от других гидридов, таких как сероводород и фтористый водород, которые образуют кислые водные растворы, аммиак растворяется в воде с образованием гидроксида аммония, который является основным (за счет образования иона гидроксида в отличие от гидроксония ). Фосфин также растворим в воде. Арсин и стибин в меньшей степени, и неизвестно, является ли висмутин.
| Названия соединений | Химическая формула | Геометрия | Модель, заполняющая пространство |
|---|---|---|---|
| гидрид азота. аммиак. (азан) | NH3 |  |  |
| гидрид фосфора. фосфин. (фосфан) | PH3 | 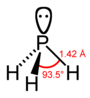 |  |
| гидрид мышьяка. арсин. (арсан) | AsH 3 |  |  |
| гидрид сурьмы. стибин. (стибан) | SbH 3 |  |  |
| гидрид висмута. висмутин. (висмутан) | BiH 3 |  |  |
Ниже приведены некоторые свойства тригидридов пниктогена:
| Свойство | NH3 | PH3 | AsH 3 | SbH 3 | BiH 3 |
|---|---|---|---|---|---|
| Температура плавления (° C) | -77,8 | −133,5 | −116,3 | −88 | ? |
| Точка кипения (° C) | −34,5 | −87,5 | - 62,4 | -18,4 | 16,8 (экстраполированный) |
| Плотность жидкости (г / см) | 0,683 (-34 ° C) | 0,746 ( -90 ° C) | 1,640 (-64 ° C) | 2,204 (-18 ° C) | ? |
| ΔH. f/ кДж моль | -46,1 | −9,6 (?) | +66,4 | +145,1 | +277,8 |
| Расстояние (X – H) / пм | 101,7 | 141,9 | 151,9 | 170,7 | 177,59 |
| Угл. le H – X – H | 107,8 ° | 93,6 ° | 91,8 ° | 91,3 ° | 90,48 ° |
Эти Газы не имеют запаха в чистом виде, а приобретают его при контакте с воздухом. Аммиак имеет печально известный интенсивный запах, напоминающий мочу и / или рыбу, обычно являющийся результатом разложения мочевины. Фосфин пахнет рыбой или чесноком, а стибин - тухлыми яйцами, похож на сероводород и селенид.
| Названия соединений | Химическая формула | Геометрия | Модель, заполняющая пространство |
|---|---|---|---|
| диазотоводород. гидразин. (диазан) | N2H4 |  |  |
| гидрид дифосфора. дифосфин. (дифосфан ) | P2H4 | 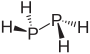 |  |
| гидрид диарьяка. диарсин. () | As2H4 |  |  |
Все насыщенные водородные пниктиды с прямой цепью подчиняются формуле X nHn + 2.

 Модели фосфанов длиной 3 и 4
Модели фосфанов длиной 3 и 4 Аммиак промышленно производится на самый крупный масштаб среди всех соединений. Подобно воде, водородная связь приводит к высокой температуре плавления и кипения по сравнению с другими гидридами пниктогена, хотя 26% теряется при плавлении, еще 7% при нагревании жидкости до при кипении, а остальные 67% - при кипении. Другими эффектами водородной связи являются высокая диэлектрическая проницаемость, а также низкие значения плотности, вязкости и электропроводности. Как и вода, это отличный и часто используемый ионизирующий растворитель. Известно более двадцати других гидридов азота, наиболее важными из которых являются гидразин (N2H4) и азид водорода (HN 3). Гидразин имеет физические свойства, которые очень похожи на свойства воды: его точки плавления и кипения составляют 2,0 ° C и 113,5 ° C, плотность твердого вещества при -5 ° C составляет 1,146 г / см, а плотность жидкости при 25 ° C. ° C составляет 1,00 г / см. азаны представляют собой ряд, включающий аммиак, гидразин и триазан.
Фосфин, токсичный бесцветный газ, является наиболее стабильным гидридом фосфора и первым из ряда гомологичных полифосфанов с прямой цепью. P nHn + 2 (n = 1–9), которые становятся все более термически нестабильными с увеличением n. Известны другие циклические и конденсированные полифосфановые серии от P nHnдо P nHn-18, что составляет 85 известных фосфанов в 1997 году. Нерастворим в воде, но растворим в органических жидкостях (а также углерод дисульфид и трихлоруксусная кислота ), фосфин является сильным восстановителем.
Арсин, стибин и висмутин являются высокотоксичными, термически нестабильными и бесцветными газами. Не обнаруживается заметной водородной связи в фосфине, арсине, стибине или висмутине, и отсутствует заметная тенденция к диссоциации, как аммиак, до MH. 4и MH. 2(M = P, As, Sb, Bi). Гидриды пниктогена уплотняются вниз по группе, длина связей M – H увеличивается, а валентный угол H – M – H немного уменьшается. Стандартные энтальпии образования отражают возрастающую термическую нестабильность по группе. Арсин разлагается на мышьяк и водород при 250–300 ° C, стибин до сурьмы и водород при комнатной температуре, а висмутин до висмута и водород выше -45 ° C. Арсин и стибин очень легко окисляются до триоксида мышьяка или сурьмы и воды; аналогичная реакция происходит с серой или селеном. Реакция с металлами при повышенных температурах приводит к арсенидам и антимонидам. Известно несколько низших гидридов, таких как As 2H4, но они еще более нестабильны, и их свойства неизвестны.
Имидоген, радикал, состоящий из одного атома водорода и одного атома азота (NH), может классифицироваться как гидрид пниктогена.