 Развертка линейного потенциала
Развертка линейного потенциала Вольтамперометрия - это категория электроаналитических методов, используемых в аналитической химии и различных промышленных процессах. В вольтамперометрии информацию об аналите получают путем измерения тока при изменении потенциала. Аналитические данные для вольтамперометрического эксперимента представлены в виде вольтамперограммы, которая отображает ток, производимый аналитом, в зависимости от потенциала рабочего электрода.
 Зависимость потенциала от времени для анодной вольтамперометрии
Зависимость потенциала от времени для анодной вольтамперометрии 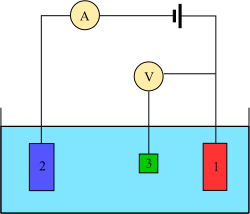 Трехэлектродная установка: (1) рабочий электрод; (2) противоэлектрод; (3) эталонный электрод
Трехэлектродная установка: (1) рабочий электрод; (2) противоэлектрод; (3) эталонный электрод в экспериментах по вольтамперометрии исследуют реактивность полуячейки аналита. Вольтамперометрия - это исследование зависимости тока от приложенного потенциала. Эти кривые I = f (E) называются вольтамперограммами. Потенциал изменяется произвольно, шаг за шагом или непрерывно, а фактическое значение тока измеряется как зависимая переменная. Обратное, т. Е. амперометрия, также возможно, но не часто. Форма кривых зависит от скорости изменения потенциала (характера движущей силы) и от того, перемешивается раствор или находится в покое (массоперенос). В большинстве экспериментов контролируется потенциал (вольт ) электрода, контактирующего с аналитом, при измерении результирующего тока (ампер ).
. Для эксперимента требуется как минимум два электрода. Рабочий электрод , который контактирует с анализируемым веществом, должен подавать желаемый потенциал контролируемым образом и способствовать передаче заряда к аналиту и от него. Второй электрод действует как другая половина ячейки. Этот второй электрод должен иметь известный потенциал, чтобы измерить потенциал рабочего электрода, кроме того, он должен уравновешивать заряд, добавляемый или удаляемый рабочим электродом. Хотя это жизнеспособная установка, она имеет ряд недостатков. Наиболее важно то, что для электрода чрезвычайно трудно поддерживать постоянный потенциал при пропускании тока для противодействия окислительно-восстановительным явлениям на рабочем электроде.
Для решения этой проблемы роль подачи электронов и обеспечение эталонного потенциала разделены между двумя отдельными электродами. электрод сравнения представляет собой полуячейку с известным восстановительным потенциалом. Его единственная роль - действовать в качестве эталона при измерении и управлении потенциалом рабочего электрода, и ни в какой точке он не пропускает какой-либо ток. Вспомогательный электрод пропускает весь ток, необходимый для балансировки тока, наблюдаемого на рабочем электроде. Для достижения этого тока вспомогательный компонент часто будет размахивать до крайних потенциалов на краях окна растворителя, где он окисляет или восстанавливает растворитель или фоновый электролит. Эти электроды, рабочий, эталонный и вспомогательный составляют современную трехэлектродную систему.
Существует много систем с большим количеством электродов, но принципы их конструкции, как правило, такие же, как и у трехэлектродной системы. Например, вращающийся кольцевой дисковый электрод имеет два различных и отдельных рабочих электрода, диск и кольцо, которые можно использовать для сканирования или удержания потенциалов независимо друг от друга. Оба этих электроды уравновешиваются одной ссылкой и вспомогательной комбинацией для общей конструкции четыре электрода. В более сложных экспериментах при необходимости могут быть добавлены рабочие электроды, а иногда и электроды сравнения или вспомогательные электроды.
На практике может оказаться важным иметь рабочий электрод с известными размерами и характеристиками поверхности. В результате рабочие электроды обычно регулярно чистят и полируют. Вспомогательный электрод может быть практически любым, если он не вступает в реакцию с основной массой раствора аналита и хорошо проводит. Ртуть в качестве рабочего электрода использовалась (или была?) DME и HMDE, а также в качестве вспомогательного средства, а метод вольтамперометрии известен как полярография. Эталон - самый сложный из трех электродов; используется множество стандартов, и их стоит изучить в другом месте. Для неводных работ IUPAC рекомендует использовать пару ферроцен / ферроцений в качестве внутреннего стандарта. В большинстве экспериментов по вольтамперометрии объемный электролит (также известный как поддерживающий электролит ) используется для минимизации сопротивления раствора. Можно провести эксперимент без объемного электролита, но добавленное сопротивление значительно снижает точность результатов. В ионных жидкостях комнатной температуры растворитель может действовать как электролит.
Анализ данных требует рассмотрения кинетики в дополнение к термодинамике из-за временной составляющей вольтамперометрии. Идеализированные теоретические электрохимические термодинамические зависимости, такие как уравнение Нернста, моделируются без временной составляющей. Хотя этих моделей недостаточно для описания динамических аспектов вольтамперометрии, такие модели, как уравнение Тафеля и уравнение Батлера – Фольмера, закладывают основу для модифицированных соотношений вольтамперометрии, которые связывают теорию с наблюдаемыми результатами..
Возникновению вольтамперометрии способствовало открытие полярографии в 1922 году лауреатом Нобелевской премии химиком Ярославом Гейровским. Ранние вольтамперометрические методы имели много проблем, что ограничивало их жизнеспособность для повседневного использования в аналитической химии. В полярографии эти проблемы включают тот факт, что ртуть окисляется при потенциале более положительном, чем +0,2, что затрудняет анализ результатов для аналитов в положительной области потенциала. Другая проблема заключалась в остаточном токе, возникающем при зарядке большой емкости поверхности электрода. Когда Гейровский впервые зарегистрировал первую зависимость тока, протекающего через падающий ртутный электрод, от приложенного потенциала в 1922 году, он провел измерения по точкам и построил вольт-амперную кривую. Это считалось первой полярограммой. Чтобы облегчить этот процесс, он вместе с М. Шикатой сконструировал так называемый полярограф, который позволил ему сфотографировать ту же кривую за считанные часы. Он признал важность потенциала и управления им, а также признал возможности измерения ограничивающих токов. Он также был важным участником внедрения ртутного ртутного электрода в качестве современного инструмента.
В 1942 году Арчи Хиклинг построил первый потенциостат с тремя электродами, что явилось достижением в области электрохимии. Он использовал этот потенциостат для управления напряжением электрода. Тем временем, в конце 1940-х годов Кеннет Коул изобрел электронную схему, которую он назвал зажимом напряжения. Зажим напряжения использовался для анализа ионной проводимости в нервах.
1960-е и 1970-е годы ознаменовались значительным прогрессом в теории и приборостроении, а также внедрением компьютерных систем с добавлением и управлением. Современные полярографические и вольтамперометрические методы на ртутных электродах представлены в трех разделах.
Первый раздел включает разработку ртутных электродов. Были изготовлены следующие электроды: капельный ртутный электрод, ртутный паровой электрод, висящий ртутный капельный электрод, статический ртутный капельный электрод, ртутный пленочный электрод, электроды из ртутной амальгамы, ртутные микроэлектроды, химически модифицированные ртутные электроды, ртутные электроды с контролируемым ростом и стягивающиеся ртутные электроды..
Произошло также усовершенствование используемых методов измерения. Эти методы измерения включают в себя: классическую полярографию постоянного тока, осциллополярографию, переключатель Калусека, полярографию переменного тока, магнитную поляографию, нормальную импульсную полярографию, дифференциальную импульсную полярографию, прямоугольную вольтамперометрию, циклическую вольтамперометрию, анодную вольтамперометрию, методы свертки и методы исключения.
Наконец, были также усовершенствованы методы предварительного концентрирования, которые привели к увеличению чувствительности ртутных электродов. Это произошло благодаря развитию анодной вольтамперометрии, катодной вольтамперометрии и адсорбционной вольтамперометрии.
Эти достижения улучшили чувствительность и создали новые аналитические методы, которые побудили промышленность отреагировать на производство более дешевых потенциостатов , электроды и ячейки, которые можно эффективно использовать в повседневной аналитической работе.
Для определения конкретных видов, представляющих интерес для промышленности и исследований, коммерчески производится ряд вольтамперометрических систем. Эти устройства иногда называют электродами, но на самом деле они представляют собой полные вольтамперометрические ячейки, и их лучше называть датчиками. Эти датчики могут использоваться для анализа различных органических и неорганических аналитов в различных матрицах.
Определение растворенного кислорода в различных водных средах, таких как морская вода, кровь, сточные воды, сточные воды химических заводов и почвы имеют огромное значение для промышленности, биомедицинских и экологических исследований, а также клинической медицины. Один из наиболее распространенных и удобных методов проведения таких измерений - использование кислородного датчика Clark, запатентованного L.C. Кларк-младший в 1956 г.