 | |
| Имена | |
|---|---|
| Название IUPAC Хлордиэтилалюминий | |
| Другие имена Хлордиэтилалюминий | |
| Идентификаторы | |
| Номер CAS | |
| 3D-модель (JSmol ) | |
| Ссылка Beilstein | 4123259 |
| ChemSpider | |
| ECHA InfoCard | 100.002.253 |
| Номер EC |
|
| PubChem CID | |
| Номер RTECS |
|
| UNII | |
| Номер ООН | 3394 |
| CompTox Dashboard (EPA ) | |
InChI
| |
SMILES
| |
| Свойства | |
| Химическая формула | C4H10AlCl |
| Молярная масса | 120,56 г · моль |
| Плотность | 0,961 г / см |
| Температура плавления | -50 ° C (-58 ° F; 223 K) |
| Температура кипения | от 125 до 126 ° C (от 257 до 259 ° F; от 398 до 399 K) при 50 мм рт. Ст. |
| Давление пара | 3 мм рт. Ст. (При 60 ° C) |
| Опасности | |
| Классификация ЕС (DSD) (устаревшая) | |
| R-фразы (устаревшие) | R14 / 15, R17, R34 |
| S-фразы (устаревшие) | S26, S36 / 37/39, S43, S45 |
| NFPA 704 (огненный алмаз) |  4 3 2 4 3 2 |
| Температура вспышки | −18 ° C (0 ° F; 255 K) |
| Если не указано иное, данные приведены для материалов в их стандартном состоянии (при 25 ° C [77 ° F], 100 кПа | |
| Ссылки в ink | |
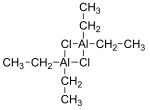
Хлорид диэтилалюминия, сокращенно DEAC, представляет собой алюминийорганическое соединение. Хотя обычно используется химическая формула (C2H5)2AlCl, он существует в виде димера, [(C 2H5)2AlCl] 2 Это предшественник катализаторов Циглера-Натта используется для производства полиолефинов. Соединение также представляет собой кислоту Льюиса, используемую в органическом синтезе. Соединение представляет собой бесцветное воскообразное твердое вещество, но обычно с ним обращаются как раствор в углеводородных растворителях. Он обладает высокой реакционной способностью, даже пирофорным.
Соединения эмпирической формулы AlR 2 Cl (R = алкил, арил ) существуют в виде димеров с формулой ( R 2 Al) 2 (μ-Cl) 2. Алюминий имеет четырехгранную геометрию.
Хлорид диэтилалюминия может быть получен из полуторного хлорида этилалюминия, (C 2H5)3Al2Cl3, восстановлением натрием:
Также получают из реакция триэтилалюминия с соляной кислотой:
Также могут быть использованы реакции репропорционирования:
хлорид диэтилалюминия и другие алюминийорганические соединения используется в сочетании с соединениями переходных металлов в качестве катализаторов Циглера-Натта для полимеризации различных алкенов.
В качестве кислоты Льюиса хлорид диэтилалюминия также используется в органическом синтезе. Например, он используется для катализирования реакций Дильса – Альдера и ена. С другой стороны, он может реагировать как нуклеофил или акцептор протонов.
Хлорид диэтилалюминия не только горюч, но и пирофорен.