| Хориидеремия | |
|---|---|
| Другие названия | ХМ, тапетохориоидальная дистрофия |
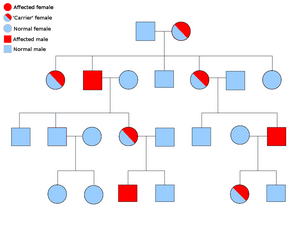 | |
| Пример родословной, показывающий наследование связанное с полом расстройство, такое как хориидеремия. | |
| Специальность | Офтальмология |
| Симптомы | Прогрессирующая потеря зрения |
| Обычное начало | Детство |
| Продолжительность | Хронические |
| Причины | Генетические |
| Диагностический метод | Генетическое тестирование, семейный анамнез, осмотр глазного дна |
Хоридеремия (; CHM ) представляет собой редкую Х-сцепленную рецессивную форму наследственной дегенерации сетчатки, которая поражает примерно 1 из 50 000 мужчин. Заболевание вызывает постепенную потерю зрения, начиная с детской куриной слепоты, за которой следует потеря периферического зрения и прогрессирующая потеря центрального зрения в более позднем возрасте. Прогресс продолжается на протяжении всей жизни человека, но скорость изменений и степень потери зрения варьируются среди пострадавших, даже в пределах одной семьи.
Хоридеремия вызывается потерей функции мутация в гене CHM , который кодирует Rab-эскорт-белок 1 (REP1), белок, участвующий в липидной модификации Rab-белков. Хотя полный механизм заболевания до конца не изучен, отсутствие функционального белка в сетчатке приводит к гибели клеток и постепенному ухудшению пигментного эпителия сетчатки (RPE), фоторецепторов и сосудистой оболочки.
По состоянию на 2019 год лечения хориидеремии не существует; однако клинические испытания ретинальной генной терапии продемонстрировали возможное лечение.
Поскольку ген CHM расположен на Х-хромосоме, симптомы наблюдаются почти исключительно у мужчин. Хотя есть несколько исключений, женщины-носительницы имеют заметное отсутствие пигментации в RPE, но не испытывают никаких симптомов. Женщины-носители имеют 50% шанс иметь либо пораженного сына, либо дочь-носителя, в то время как мужчина с хориидеремией будет иметь всех дочерей-носителей и здоровых сыновей.
Несмотря на то, что течение болезни может значительно варьироваться, есть общие тенденции. Первым симптомом, который замечают многие люди с хориидеремией, является значительная потеря зрения в ночное время, которая начинается в молодости. Периферическое зрение потеря зрения происходит постепенно, начиная с кольцевой потери зрения и продолжая до "туннельного зрения" в совершеннолетие. Люди с хориидеремией, как правило, сохраняют хорошую остроту зрения до 40 лет, но в конечном итоге теряют зрение в какой-то момент в возрасте 50–70 лет. Исследование 115 человек с хориидеремией показало, что 84% пациентов в возрасте до 60 лет имели остроту зрения 20/40 или выше, в то время как 33% пациентов старше 60 лет имели остроту зрения 20 / 200 или хуже. Наиболее серьезное нарушение остроты зрения (только умение считать по пальцам или хуже) не наблюдалось до седьмого десятилетия жизни. В том же исследовании было обнаружено, что средняя скорость потери остроты зрения составляет около 0,09 logMAR за 5 лет, что составляет примерно 1 строку на диаграмме Снеллена.
Диагноз. Хориидеремия может быть определена на основании семейного анамнеза, симптомов и характерного внешнего вида глазного дна. Однако хориидеремия имеет несколько общих клинических признаков с пигментным ретинитом, аналогичной, но более широкой группой дегенеративных заболеваний сетчатки, что затрудняет постановку конкретного диагноза без генетического тестирования. Из-за этого хоридеремию часто изначально ошибочно принимают за пигментный ретинит. Для проведения дифференциального диагноза можно использовать множество различных генетических методов тестирования.
Хотя в настоящее время ничего нельзя сделать, чтобы остановить или обратить вспять дегенерацию сетчатки, есть это шаги, которые можно предпринять, чтобы замедлить скорость потери зрения. Рекомендуются солнцезащитные очки, блокирующие УФ-излучение, для использования на открытом воздухе, соответствующее диетическое потребление свежих фруктов и листовых зеленых овощей, антиоксидантные витаминные добавки и регулярный прием диетических жирных кислот омега-3 с очень длинной цепью. Одно исследование показало, что пищевая добавка лютеина увеличивает уровень макулярного пигмента у пациентов с хоридеремией. В течение длительного периода времени эти повышенные уровни пигментации «могли» замедлить дегенерацию сетчатки. Дополнительные вмешательства, которые могут потребоваться, включают хирургическую коррекцию отслоения сетчатки и катаракты, услуги по лечению слабовидящих и консультирование, чтобы помочь справиться с депрессией, потерей независимости и беспокойством по поводу потери работы.
Генная терапия в настоящее время не является вариантом лечения, однако клинические испытания на людях как в отношении хориидеремии, так и врожденного амавроза Лебера (LCA) дали несколько многообещающие результаты.
Клинические испытания генной терапии для пациентов с LCA началось в 2008 году в трех разных центрах. В целом эти исследования показали, что терапия безопасна, в некоторой степени эффективна и многообещающа в качестве будущего лечения подобных заболеваний сетчатки.
В 2011 году была проведена первая генная терапия хориидеремии. Операцию выполнил Роберт Макларен, профессор офтальмологии Оксфордского университета и руководитель исследовательской группы клинической офтальмологии в лаборатории офтальмологии Наффилда (NLO). В исследовании 2 дозы вектора AAV.REP1 вводили субретинально 12 пациентам с хориидеремией. Это исследование преследовало 2 цели:
Несмотря на отслоение сетчатки, вызванное инъекцией, исследование выявило первоначальное улучшение функции палочек и колбочек, что требует дальнейшего изучения.
В 2016 году исследователи были оптимистичны в отношении того, что положительные результаты 32 пациентов с хоридеремией, получавших генную терапию в течение четырех с половиной лет в четырех странах, могут быть долгосрочными.
Для женщин, несущих мутацию в гене CHM, преимплантационная генетическая диагностика может использоваться в процессе экстракорпорального оплодотворения для выбора незатронутых эмбрионов для имплантации. Этот вызов процесса можно применить к любому моногенному заболеванию.
Хотя хориидеремия является идеальным кандидатом для генной терапии, существуют и другие потенциальные методы лечения, которые могут восстановить зрение после его утраты в более позднем возрасте. Прежде всего, это терапия стволовыми клетками . Клиническое исследование, опубликованное в 2014 году, показало, что субретинальная инъекция человеческих эмбриональных стволовых клеток пациентам с возрастной дегенерацией желтого пятна и болезнью Штаргардта была безопасной и улучшила зрение. у большинства пациентов. Из 18 пациентов зрение улучшилось у 10, улучшилось или осталось таким же у 7 и уменьшилось у 1 пациента, в то время как на необработанных глазах улучшения не наблюдалось. Исследование не обнаружило «никаких доказательств неблагоприятного распространения, отторжения или серьезных глазных или системных проблем безопасности, связанных с трансплантированной тканью». В исследовании 2015 года CRISPR / Cas9 использовалось для исправления мутаций в индуцированных пациентами плюрипотентных стволовых клетках, которые вызывают пигментный Х-сцепленный ретинит. Это исследование предполагает, что собственные восстановленные клетки пациента могут быть использованы для терапии, что снижает риск иммунного отторжения и этических проблем, связанных с использованием эмбриональных стволовых клеток.
Хориидеремия была впервые описана в 1872 году австрийским офтальмологом Людвигом Маутнером. Первоначально считалось, что это нарушение развития, которое вызывало отсутствие большей части сосудистой оболочки (отсюда вероятное использование древнегреческого суффикса «эремия», что означает бесплодная земля или пустыня). Спустя несколько десятилетий непрогрессивный характер заболевания был поставлен под сомнение, и в конечном итоге был отвергнут Paymerer et al. в 1960 году. Ген CHM был идентифицирован и клонирован в 1990 году Франсом П.М. Кремерс.
Во многих наследственных заболеваниях сетчатки белок, затронутый мутацией, напрямую участвует в светочувствительной функции глаза, однако это не относится к хориидеремии. REP1 способствует пренилированию Rab G-белков путем связывания и представления их с субъединицей Rab геранилгеранилтрансферазы. REP1 также сопровождает пренилированный Rab через цитоплазму, связывая гидрофобные пренильные группы и перенося их к определенной целевой мембране.
У здоровых людей REP1 обнаруживается повсюду. клеток организма, однако пациенты с хориидеремией испытывают только потерю зрения, а не более широкие системные симптомы (за исключением исследования, которое обнаружило аномалии кристаллов и жирных кислот в лейкоцитах ). REP2, белок, который на 75% идентичен и на 90% похож на REP1, способен значительно компенсировать потерю REP1 за пределами глаза. Считается, что REP2 не способен полностью компенсировать потерю REP1 в сетчатке. RAB27A, Rab, который выполняет важные функции в сетчатке, предпочтительно пренилируется REP1. Кроме того, комплексы Rab27a-REP1 и Rab27a-REP2 имеют разное сродство к ферменту Rab геранилгеранилтрансферазы, что, возможно, объясняет неспособность REP2 полностью компенсировать REP1 в сетчатке.
Некоторые люди, занимающие общественные должности, страдают хориодермией, а некоторые участвовали в мобилизации средств на борьбу с этой болезнью. Известно, что бывший лейборист Великобритании член парламента Сион Саймон страдает этим заболеванием. Комик и активист Э.Дж. Скотт, партнер Сорвиголова актриса Дебора Энн Уолл, также страдает хориидеремией и регулярно занимается сбором средств.
| Классификация | D |
|---|