| Домен CBS | |||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
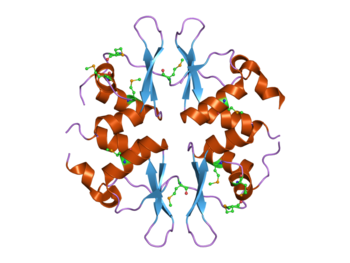 Структура дрожжевого белка SNF4, содержащего четыре домена CBS. Этот белок является частью комплекса AMP-активируемой протеинкиназы (AMPK). Структура дрожжевого белка SNF4, содержащего четыре домена CBS. Этот белок является частью комплекса AMP-активируемой протеинкиназы (AMPK). | |||||||||||
| Идентификаторы | |||||||||||
| Symbol | CBS | ||||||||||
| Pfam | PF00571 | ||||||||||
| InterPro | IPR000644 | ||||||||||
| SMART | CBS | ||||||||||
| PROSITE | PS51371 | ||||||||||
| SCOPe | 1zfj / SUPFAM | ||||||||||
| CDD | cd02205 | ||||||||||
| |||||||||||
В молекулярной биологии домен CBS представляет собой белковый домен, обнаруженный в ряде белков у всех видов, от бактерий до людей. Впервые он был идентифицирован как область консервативной последовательности в 1997 году и назван в честь цистатионин-бета-синтазы, одного из белков, в котором он обнаружен. Домены CBS также встречаются во множестве других белки, такие как инозинмонофосфатдегидрогеназа, потенциалозависимые хлоридные каналы и AMP-активированная протеинкиназа (AMPK). Домены CBS регулируют активность ассоциированных ферментных и переносных доменов в ответ на связывание молекул с аденозильными группами, такими как AMP и ATP, или s-аденозилметионин.
Домен CBS состоит из бета-альфа-бета -бета-альфа вторичная структура узор, который свернут в глобулярную третичную структуру, которая содержит трехцепочечный антипараллельный β-лист с две α-спирали с одной стороны. Домены CBS всегда находятся парами в белковых последовательностях, и каждая пара этих доменов тесно связана в псевдодимерном расположении через свои β-листы, образуя так называемую CBS-пару или домен Бейтмана . Эти пары доменов CBS могут быть связаны между собой (например, коды PDB 3KPC, 1PVM, 2OOX ) или по принципу «один-на-один». хвост (т.е. коды PDB 1050, 1PBJ ) образуют дискообразную компактную структуру. Поступая таким образом, они образуют щели, которые составляют канонические области связывания лиганда. В принципе, количество канонических сайтов связывания соответствует количеству CBS-доменов в молекуле и традиционно нумеруются в соответствии с CBS-доменом, который содержит каждый из консервативных остатков аспартата, которые потенциально взаимодействуют с рибозой нуклеотидов. Однако не все эти полости могут обязательно связывать нуклеотиды или быть функциональными. Недавно неканонический сайт для AMP был также описан в белке MJ1225 из M. jannaschii, хотя его функциональная роль все еще неизвестна.
 Множественное выравнивание последовательностей доменов CBS, показывающих вышеупомянутые вторичные структуры. Желтые стрелки представляют бета-цепи, а красные прямоугольники - альфа-спирали.
Множественное выравнивание последовательностей доменов CBS, показывающих вышеупомянутые вторичные структуры. Желтые стрелки представляют бета-цепи, а красные прямоугольники - альфа-спирали. Было показано, что домены CBS связываются с аденозильными группами в таких молекулах, как AMP и ATP или s-аденозилметионин, но они также могут связывать ионы металлов, такие как Mg. Связывая эти разные лиганды, домены CBS регулируют активность связанных ферментативных доменов. Молекулярные механизмы, лежащие в основе этой регуляции, только начинают выясняться. На данный момент предложены два разных типа механизмов. Первый утверждает, что нуклеотидная часть лиганда практически не вызывает изменений в структуре белка, причем электростатический потенциал в сайте связывания является наиболее важным свойством связывания аденозиновых нуклеотидов. Этот «статический» отклик будет задействован в процессах, в которых регулирование энергетическим зарядом было бы выгодным. Напротив, второй тип механизма (обозначаемый как «динамический») включает драматические конформационные изменения в структуре белка при связывании лиганда и описан для цитозольного домена переносчика Mg MgtE из Thermus thermophilus, белок с неизвестной функцией MJ0100 из M. jannaschii и регуляторная область Clostridium perfringens пирофосфатаза.
Домены CBS часто обнаруживаются в белках, которые содержат другие домены. Эти домены обычно являются ферментативными, мембранными переносчиками или ДНК-связывающими доменами. Однако также часто встречаются белки, содержащие только домены CBS, особенно у прокариот. Эти автономные белки домена CBS могут образовывать комплексы при связывании с другими белками, такими как киназы, с которыми они взаимодействуют и регулируют.
 Обнаружены примеры доменов белков, связанных с доменами CBS
Обнаружены примеры доменов белков, связанных с доменами CBS Мутации в некоторых белках, содержащих домен CBS человека, приводят к генетическим заболеваниям. Например, мутации в белке цистатионин-бета-синтаза приводят к наследственному нарушению метаболизма, называемому гомоцистинурией (OMIM: 236200 ). Было показано, что мутации в гамма-субъединице фермента AMPK приводят к семейной гипертрофической кардиомиопатии с синдромом Вольфа-Паркинсона-Уайта (OMIM: 600858 ). Мутации в доменах CBS фермента IMPDH приводят к состоянию глаз пигментный ретинит (OMIM: 180105 ).
У людей есть ряд генов потенциал-управляемых хлоридных каналов, и мутации в доменах CBS некоторых из них были идентифицированы как причина генетических заболеваний. Мутации в CLCN1 приводят к миотонии (OMIM: 160800 ), мутации в CLCN2 могут привести к идиопатической генерализованной эпилепсии (OMIM: 600699 ), мутации в CLCN5 могут привести к болезни Дента (OMIM: 300009 ), мутации в CLCN7 может привести к остеопетрозу (OMIM: 259700 ), а мутации в CLCNKB могут привести к синдрому Барттера (OMIM: 241200 ).