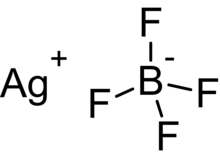 | |
 | |
| Имена | |
|---|---|
| Название ИЮПАК Тетрафтороборат серебра (1–) | |
| Другие имена Борат ( 1-), тетрафтор-, серебро (1+). Аргентотетрафторборат | |
| Идентификаторы | |
| Номер CAS | |
| 3D-модель (JSmol ) | |
| ChemSpider | |
| ECHA InfoCard | 100.034.491 |
| Номер EC |
|
| PubChem CID | |
| RTECS номер |
|
| CompTox Dashboard (EPA ) | |
InChI
| |
УЛЫБКИ
| |
| Свойства | |
| Химическая формула | AgBF 4 |
| Молярная масса | 194,673 г / моль |
| Внешний вид | Беловатый порошок |
| Запах | почти без запаха |
| Плотность | 0,936 г / см |
| точка плавления | 71,5 ° C (160,7 ° F; 344,6 K) |
| Растворимость в воде | растворимый |
| Опасности | |
| Паспорт безопасности | Внешний паспорт безопасности материала |
| Классификация ЕС (DSD) (устарело) | Коррозийный (C) |
| NFPA 704 (огненный алмаз) |  0 3 0 0 3 0 |
| Если не указано иное, данные приведены для материалов в их стандартном состоянии (при 25 ° C [77 ° F ], 100 кПа). | |
| Ссылки в ink | |
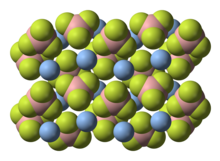
Тетрафторборат серебра представляет собой неорганическое соединение с химической формулой AgBF 4. Это белое твердое вещество, которое растворяется в полярных органических растворителях, а также в воде. В твердом состоянии центры Ag связаны с фторидом.
Серебро тетрафторборат получают реакцией между трифторидом бора и оксидом серебра в присутствии бензола.
В неорганических и металлоорганическая химия лаборатория, тетрафторборат серебра, иногда называемый «серебро BF-4», является полезным реагентом. В дихлорметане Кроме того, тетрафторборат серебра является умеренно сильным окислителем. Подобно гексафторфосфату серебра, он обычно используется для замены галогенидных анионов или лигандов слабо координирующими анионами тетрафторборат. Выделение галогенида происходит за счет осаждения соответствующего галогенида серебра.