Позитронно-эмиссионная томография для визуализации костей как метод трассировки in vivo позволяет измерять региональную концентрацию радиоактивности, пропорциональную значениям пикселей изображения, усредненным по интересующей области (ROI) в костях. Позитронно-эмиссионная томография - это метод функциональной визуализации, в котором используется радиоактивный индикатор [ 18 F] NaF для визуализации и количественной оценки регионального костного метаболизма и кровотока. [ 18 F] NaF использовался для визуализации костей в течение последних 60 лет. В этой статье основное внимание уделяется фармакокинетике [ 18 F] NaF в костях, а также различным полуколичественным и количественным методам количественной оценки регионального костного метаболизма с использованием изображений [ 18 F] NaF ПЭТ.
Измерение регионального костного метаболизма имеет решающее значение для понимания патофизиологии метаболических заболеваний костей.
Химически стабильный анион, из фтора-18-Фтор является костью -seeking радиотрейсер в скелетной визуализации. [ 18 F] NaF имеет свойство откладываться в областях, где кость вновь минерализуется. Во многих исследованиях используется ПЭТ с [ 18 F] NaF для измерения метаболизма в костях бедра, поясничного отдела позвоночника и плечевой кости. [ 18 F] NaF усваивается экспоненциально, что представляет собой уравновешивание индикатора с внеклеточными и клеточными жидкостными пространствами с периодом полураспада 0,4 часа и почками с периодом полураспада 2,4 часа. Экстракция [ 18 F] NaF в кости за один проход составляет 100%. Через час в крови остается только 10% введенной активности.
Считается, что ионы 18 F- занимают пространства внеклеточной жидкости, потому что, во-первых, они уравновешиваются с пространствами трансклеточной жидкости, а во-вторых, они не являются полностью внеклеточными ионами. Фторид находится в равновесии с фтористым водородом, который обладает высокой проницаемостью, позволяя фториду проникать через плазматическую мембрану крови. На циркуляцию фтора в эритроцитах приходится 30%. Однако он свободно доступен на поверхности кости для поглощения, потому что равновесие между эритроцитами и плазмой намного быстрее, чем время прохождения по капиллярам. Это подтверждается исследованиями, в которых сообщается о 100% экстракции за один проход иона 18 F- из цельной крови костью и о быстром высвобождении ионов 18 F- из эритроцитов с константой скорости 0,3 в секунду.
[ 18 F] NaF также поглощается незрелыми эритроцитами в костном мозге, что играет роль в кинетике фторидов. Связывание [ 18 F] NaF с белками плазмы незначительно. [ 18 F] Почечный клиренс NaF зависит от диеты и уровня pH из-за его реабсорбции в нефроне, которая опосредуется фтористым водородом. Тем не менее, больших различий в скорости потока мочи можно избежать в контролируемых экспериментах, сохраняя патенты хорошо гидратированными.
Обмениваемый пул и размер метаболически активных поверхностей в костях определяет количество индикатора, накопленного или обмененного с костной внеклеточной жидкостью, хемосорбцию кристаллами гидроксиапатита с образованием фторапатита, как показано в уравнении-1:
Уравнение-1
Ионы фтора из кристаллического матрикса кости высвобождаются при ремоделировании кости, что позволяет измерить скорость метаболизма кости.
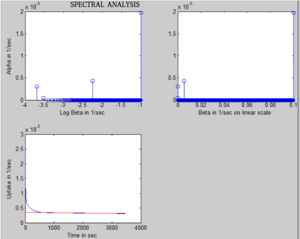 Два изображения в верхнем ряду (изображение слева нанесено в логарифмическом масштабе, а справа - в линейном масштабе) показывают результат спектрального анализа, показывающий его частотные составляющие, сгруппированные вокруг трех кластеров, которые называются как высокие, промежуточные и низкие частоты, подтверждая предположение о трех компартментах в модели Хокинса, соответствующих плазме, ECF кости и минеральному компартменту кости соответственно. Изображение в нижней строке показывает IRF, построенную с использованием ранее полученных частотных составляющих.
Два изображения в верхнем ряду (изображение слева нанесено в логарифмическом масштабе, а справа - в линейном масштабе) показывают результат спектрального анализа, показывающий его частотные составляющие, сгруппированные вокруг трех кластеров, которые называются как высокие, промежуточные и низкие частоты, подтверждая предположение о трех компартментах в модели Хокинса, соответствующих плазме, ECF кости и минеральному компартменту кости соответственно. Изображение в нижней строке показывает IRF, построенную с использованием ранее полученных частотных составляющих. Стандартизированы поглощение значение (SUV) определяется как тканевой концентрации (кБк / мл), разделенной на активности впрыскиваемого нормализовали по массе тела.
SUV, измеренный по большой ROI, сглаживает шум и, следовательно, более подходит для исследований [ 18 F] NaF костей, поскольку радиоактивный индикатор довольно равномерно поглощается по всей кости. Измерение SUV выполняется легко, дешево и быстро, что делает его более привлекательным для клинического использования. Он использовался для диагностики и оценки эффективности терапии. Внедорожник можно измерить на одном участке или на всем скелете с помощью серии статических сканирований, ограниченных небольшим полем обзора ПЭТ-сканера.
Внедорожник превратился в клинически полезный, хотя и противоречивый, полуколичественный инструмент в ПЭТ-анализе. Стандартизация протоколов визуализации и измерение SUV в одно и то же время после инъекции радиоактивного индикатора необходимы для получения правильного SUV, потому что визуализация до плато поглощения вводит непредсказуемые ошибки до 50% для SUV. Шум, разрешение изображения и реконструкция влияют на точность SUV, но коррекция с помощью фантома может минимизировать эти различия при сравнении SUV для многоцентровых клинических испытаний. SUV может не обладать чувствительностью при измерении реакции на лечение, поскольку это простая мера поглощения индикатора в кости, на которую влияет поглощение индикатора в других конкурирующих тканях и органах в дополнение к целевой ROI.
Количественная оценка динамических ПЭТ-исследований для измерения Ki требует измерения скелетных кривых время-активность (TAC) из интересующей области (ROI) и артериальной входной функции (AIF), которые можно измерить различными способами. Однако наиболее распространенной является корректировка кривых зависимости активности крови от времени на основе изображений с использованием нескольких проб венозной крови, взятых в дискретные моменты времени во время сканирования пациента. Расчет констант скорости или K i требует трех шагов:
 ОДУ кости моделируется как свертка измеренной входной функции артерии с IRF. Оценки IRF получаются итеративно, чтобы минимизировать различия между кривой кости и сверткой оцененной IRF с кривой входной функции. Кривая зеленого цвета показывает начальные оценки IRF, а синяя кривая - окончательная IRF, которая минимизирует различия между оцененной кривой кости и истинной кривой кости. K i получается из пересечения линейной аппроксимации с медленной составляющей этой экспоненциальной кривой, которая считается плазменным клиренсом к костному минералу, т.е. когда красная линия пересекает ось y.
ОДУ кости моделируется как свертка измеренной входной функции артерии с IRF. Оценки IRF получаются итеративно, чтобы минимизировать различия между кривой кости и сверткой оцененной IRF с кривой входной функции. Кривая зеленого цвета показывает начальные оценки IRF, а синяя кривая - окончательная IRF, которая минимизирует различия между оцененной кривой кости и истинной кривой кости. K i получается из пересечения линейной аппроксимации с медленной составляющей этой экспоненциальной кривой, которая считается плазменным клиренсом к костному минералу, т.е. когда красная линия пересекает ось y. Метод был впервые описан Cunningham amp; Jones в 1993 году для анализа динамических данных ПЭТ, полученных в головном мозге. Предполагается, что функция импульсного отклика ткани (IRF) может быть описана как комбинация многих экспонент. Так как TAC ткани может быть выражено как свертка измеренной входной функции артерии с IRF, C bone (t) может быть выражена как:
где, - оператор свертки, C bone (t) - концентрация индикатора активности в костной ткани (в единицах: МБк / мл) за период времени t, C плазма (t) - концентрация индикатора в плазме (в единицах: МБк / мл) в течение периода времени t, IRF (t) равна сумме экспонент, значения β фиксируются между 0,0001 с −1 и 0,1 с −1 с интервалами 0,0001, n - количество компонентов α, которые полученный в результате анализа, и β 1, β 2,…, β n соответствуют соответствующим компонентам α 1, α 2,…, α n из полученного спектра. Значения α затем оцениваются на основе анализа путем подгонки многоэкспоненциальной функции к IRF. Пересечение линейной аппроксимации с медленным компонентом этой экспоненциальной кривой считается плазменным клиренсом (K i) до минерала кости.
Метод был впервые описан Williams et al. в клиническом контексте. Этот метод использовался во многих других исследованиях. Это, пожалуй, самый простой из всех математических методов вычисления K i, но наиболее чувствительный к шуму, присутствующему в данных. TAC ткани моделируется как свертка измеренной входной функции артерии с IRF, оценки IRF получаются итеративно, чтобы минимизировать различия между левой и правой частями следующего уравнения:
где, - оператор свертки, C bone (t) - концентрация индикатора активности в костной ткани (в единицах: МБк / мл) за период времени t, C плазма (t) - концентрация индикатора в плазме (в единицах: МБк / мл) за период времени t, а IRF (t) - это импульсный отклик системы (т. Е. Ткани в данном случае). К я получается из IRF аналогичным образом, полученному для спектрального анализа, как показано на рисунке.
 Схематическое изображение процесса кинетического моделирования с использованием модели Хокинса, используемой для расчета скорости метаболизма костной ткани на участке скелета. C p относится к концентрации индикатора в плазме, C e относится к концентрации индикатора в компартменте ECF, C b относится к концентрации индикатора в минеральном компартменте кости, M1 относится к массе индикатора в компартменте C e, M2 относится к масса индикатора в отсеке C b, C T - общая масса в отсеке C e + C b, PVE относится к коррекции частичного объема, FA относится к бедренной артерии, ROI относится к области интереса, B-Exp относится к биэкспоненциальной,.
Схематическое изображение процесса кинетического моделирования с использованием модели Хокинса, используемой для расчета скорости метаболизма костной ткани на участке скелета. C p относится к концентрации индикатора в плазме, C e относится к концентрации индикатора в компартменте ECF, C b относится к концентрации индикатора в минеральном компартменте кости, M1 относится к массе индикатора в компартменте C e, M2 относится к масса индикатора в отсеке C b, C T - общая масса в отсеке C e + C b, PVE относится к коррекции частичного объема, FA относится к бедренной артерии, ROI относится к области интереса, B-Exp относится к биэкспоненциальной,. Измерение Ki с помощью динамических ПЭТ-сканирований требует кинетического моделирования индикаторов для получения параметров модели, описывающих биологические процессы в кости, как описано Hawkins et al. Поскольку эта модель имеет два тканевых отсека, ее иногда называют двухтканевой компартментной моделью. Существуют разные версии этой модели; однако здесь рассматривается наиболее фундаментальный подход с двумя тканевыми компартментами и четырьмя параметрами обмена индикатора. Весь процесс кинетического моделирования с использованием модели Хокинса можно резюмировать на одном изображении, как показано на правой стороне. Для получения констант скорости решаются следующие дифференциальные уравнения:
Константа скорости K 1 (в единицах: мл / мин / мл) описывает однонаправленный клиренс фторида из плазмы по всей костной ткани, k 2 (в единицах: мин -1) описывает обратный транспорт фторида из ECF. компартмент в плазму, k 3 и k 4 (в единицах мин -1) описывают прямую и обратную транспортировку фторида из минерального компартмента кости.
K i представляет собой чистый плазменный клиренс только до минералов кости. K i является функцией как K 1, отражающего кровоток в кости, так и фракции индикатора, которая подвергается специфическому связыванию с минералом кости k 3 / ( k 2 + k 3 ). Следовательно,
Хокинс и др. обнаружили, что включение дополнительного параметра, называемого фракционным объемом крови (BV), представляющего сосудистые тканевые пространства в пределах ROI, улучшило проблему подбора данных, хотя это улучшение не было статистически значимым.
Метод Патлака основан на предположении, что обратный поток индикатора от костного минерала к костному ECF равен нулю (т.е. k 4 = 0). Расчет K i с использованием метода Патлака проще, чем с использованием нелинейной регрессии (NLR), подгоняющей входную функцию артерии и данные кривой зависимости активности ткани от времени для модели Хокинса. Важно отметить, что метод Патлака может измерять только клиренс костной плазмы ( K i ) и не может измерять отдельные кинетические параметры, K 1, k 2, k 3 или k 4.
Концентрация индикатора в интересующей области ткани может быть представлена как сумма концентраций в ECF кости и минерале кости. Математически это можно представить как
где в пределах области ткани, представляющей интерес из изображения ПЭТ, C кость (T) - это концентрация индикатора активности костной ткани (в единицах: МБк / мл) в любой момент времени T, C в плазме (T) - концентрация в плазме индикатора (в единицах: МБк / мл) в момент времени T, V o - это доля ROI, занятая компартментом ECF, а площадь под кривой плазмы - это чистая доставка индикатора в интересующую область ткани (в единицах: MBq.Sec / ml) с течением времени T. Уравнение Патлака является линейным уравнением вида
 Анализ Патлака, при котором линейная регрессия подбирается между данными по осям y и x для получения оценок Ki, который представляет собой наклон подобранной линии регрессии.
Анализ Патлака, при котором линейная регрессия подбирается между данными по осям y и x для получения оценок Ki, который представляет собой наклон подобранной линии регрессии. Таким образом, линейная регрессия аппроксимируется данными, нанесенными на оси Y и X в промежутке от 4 до 60 минут для получения значений m и c, где m - наклон линии регрессии, представляющей K i, а c - точка пересечения оси Y линия регрессии, представляющая V o.
Расчет Ki с использованием артериальной входной функции, кривой время-активность и модели Хокинса был ограничен небольшой областью скелета, покрытой узким полем обзора ПЭТ-сканера при получении динамического сканирования. Однако Сиддик и др. показали в 2012 году, что можно измерить значения K i в костях с помощью статического [ 18 F] NaF ПЭТ-сканирования. Блейк и др. позже в 2019 году показал, что K i, полученный с помощью метода Сиддика-Блейка, имеет погрешности точности менее 10%. Подход Сиддика-Блейка основан на сочетании метода Патлака, функции артериального ввода на основе полупопуляций и информации о том, что V o существенно не меняет после лечения. Этот метод использует информацию о том, что линия линейной регрессии может быть построена с использованием данных минимум из двух временных точек, чтобы получить m и c, как описано в методе Патлака. Однако, если V o известно или фиксировано, требуется только одно статическое изображение ПЭТ для получения второй временной точки для измерения m, представляющей значение K i. Этот метод следует применять с большой осторожностью в других клинических областях, где эти предположения могут не соответствовать действительности.
Наиболее фундаментальное различие между значениями SUV и K i заключается в том, что SUV - это простая мера поглощения, которая нормируется на массу тела и инъекционную активность. Внедорожник не принимает во внимание доставку индикатора в интересующую локальную область, откуда производятся измерения, поэтому на него влияет физиологический процесс, потребляющий [ 18 F] NaF в других частях тела. С другой стороны, K i измеряет плазменный клиренс до минералов кости, принимая во внимание поглощение индикатора в других частях тела, влияющее на доставку индикатора в интересующую область, из которой были получены измерения. Различия в измерении K i и SUV в костной ткани с использованием [ 18 F] NaF более подробно объяснены Blake et al.
Важно отметить, что большинство методов расчета K i требуют динамического ПЭТ-сканирования в течение часа, за исключением методов Сиддика-Блейка. Динамическое сканирование сложно и дорого. Однако для расчета SUV требуется одно статическое сканирование ПЭТ, выполняемое примерно через 45–60 минут после введения индикатора в любую область, отображаемую в пределах скелета.
Многие исследователи показали высокую корреляцию между значениями SUV и K i на различных участках скелета. Однако методы SUV и K i могут противоречить оценке ответа на лечение. Поскольку SUV не был подтвержден гистоморфометрией, его полезность в исследованиях костей, измеряющих реакцию на лечение и прогрессирование заболевания, остается неопределенной.
| Библиотечные ресурсы о ПЭТ |