Микробиоты легкие, являются легочным микробным сообщество, состоящее из сложных различных микроорганизмов найдены в нижнем дыхательных путях, особенно на слизистой оболочке и эпителиальные поверхностях. Эти микроорганизмы включают бактерии, грибы, вирусы и бактериофаги. Бактериальная часть микробиоты изучена более тщательно. Он состоит из девяти родов : Prevotella, Sphingomonas, Pseudomonas, Acinetobacter, Fusobacterium, Megasphaera., Veillonella, Staphylococcus и Streptococcus. Это аэробы, а также анаэробы и аэротолерантные бактерии. Микробные сообщества сильно различаются у отдельных людей и составляют около 140 различных семейств. Например, бронхиальное дерево содержит в среднем 2000 бактериальных геномов на 1 см 2 поверхности. Вредные или потенциально вредные бактерии также обычно обнаруживаются в респираторных образцах. Наиболее значительными из них являются Moraxella catarrhalis, Haemophilus influenzae и Streptococcus pneumoniae. Известно, что они вызывают респираторные расстройства при определенных условиях, а именно, если иммунная система человека ослаблена. Механизм их сохранения в нижних дыхательных путях у здоровых людей неизвестен.
Роды грибов, которые обычно встречаются, составляют микобиом легких в микробиоте легких и включают, среди прочего, Candida, Malassezia, Neosartorya, Saccharomyces и Aspergillus.
Эпителий дыхательных путей вместе с альвеолярными макрофагами и дендритными клетками играет важную роль в начальном распознавании бактериальных продуктов, попадающих с воздухом в нижние дыхательные пути. Поскольку некоторые из этих продуктов являются мощными провоспалительными стимулами, для иммунной системы чрезвычайно важно различать патогены и непатогенные комменсалы. Это предотвращает развитие постоянного воспаления и формирует толерантность к безвредной микробиоте.
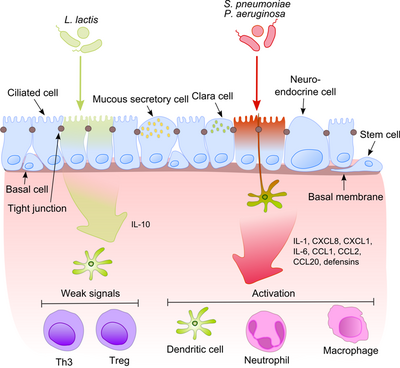 Механизмы, лежащие в основе воспаления. Эпителий дыхательных путей имеет сложную структуру, состоящую по крайней мере из семи различных типов клеток, взаимодействующих друг с другом посредством плотных контактов. Эпителиальные клетки могут передавать иммуностимулирующие сигналы в подлежащие ткани, участвуя в механизмах врожденного и адаптивного иммунного ответа. Ключевыми передатчиками этих сигналов являются дендритные клетки. Как только патогенные бактерии (например, S. pneumoniae, P. aeruginosa) активируют определенные рецепторы распознавания образов на / в эпителиальных клетках, активируются провоспалительные сигнальные пути. Это приводит в основном к продукции IL-1, IL-6 и IL-8. Эти цитокины вызывают хемотаксис к участку инфекции в своих клетках-мишенях (например, нейтрофилах, дендритных клетках и макрофагах). С другой стороны, представители стандартной микробиоты вызывают лишь слабые сигналы, предотвращающие воспаление. Механизм различения безобидных и вредных бактерий как на молекулярном, так и на физиологическом уровнях до конца не изучен.
Механизмы, лежащие в основе воспаления. Эпителий дыхательных путей имеет сложную структуру, состоящую по крайней мере из семи различных типов клеток, взаимодействующих друг с другом посредством плотных контактов. Эпителиальные клетки могут передавать иммуностимулирующие сигналы в подлежащие ткани, участвуя в механизмах врожденного и адаптивного иммунного ответа. Ключевыми передатчиками этих сигналов являются дендритные клетки. Как только патогенные бактерии (например, S. pneumoniae, P. aeruginosa) активируют определенные рецепторы распознавания образов на / в эпителиальных клетках, активируются провоспалительные сигнальные пути. Это приводит в основном к продукции IL-1, IL-6 и IL-8. Эти цитокины вызывают хемотаксис к участку инфекции в своих клетках-мишенях (например, нейтрофилах, дендритных клетках и макрофагах). С другой стороны, представители стандартной микробиоты вызывают лишь слабые сигналы, предотвращающие воспаление. Механизм различения безобидных и вредных бактерий как на молекулярном, так и на физиологическом уровнях до конца не изучен. Этот процесс становится гораздо более интригующим, если учесть, что комменсалы часто делятся своими поверхностными молекулами с патогенами. Эпителиальные клетки оснащены очень чувствительными инструментами распознавания - толл-подобными рецепторами (TLR), нуклеотид-связывающими доменами олигомеризации (NOD) -подобными рецепторами (NLR) и рецепторами, подобными I-подобным (RLR) генам, индуцируемым ретиноевой кислотой (RIG ), которые распознают широкий спектр микробных структурных компонентов. После распознавания патогенных бактерий провоспалительные пути активируются, и клеточные компоненты адаптивного и врожденного иммунитета привлекаются к месту инфекции. Одним из ключевых регуляторов этого процесса является NF-κB, который перемещается из цитоплазмы в ядро и активирует провоспалительные гены в эпителиальных клетках и макрофагах. Комплекс ДНК-связывающих белков распознает дискретную нуклеотидную последовательность (5'-GGG ACT TTC T-3 ') в вышестоящей области различных генов ответа. Активация NF-κB рядом стимулов: стенки бактериальных клеток или воспалительные цитокины приводят к его перемещению в ядро.
Напротив, безвредные бактерии не вызывают транслокацию NF-κB в ядро, предотвращая, таким образом, воспаление, хотя они могут выражать те же молекулярные паттерны, связанные с микробами (MAMP). Один возможный механизм, объясняющий этот эффект, был предложен Нейшем, показав, что непатогенные S. typhimurium PhoPc и S. pullorum способны запрещать убиквитинирование молекулы ингибитора NF-κB ядерного фактора энхансера гена легкого полипептида NF-κB в ингибиторе B-клеток. альфа (IκB-κ). Другое объяснение комменсальной толерантности эпителия относится к посттрансляционной модификации белка путем ковалентного присоединения одного или нескольких мономеров убиквитина (Ub). Ингибирование убиквитинирования приводит к уменьшению воспаления, потому что только полиубиквитинированный (IκB-κ нацелен на деградацию протеасомой 26 S, что делает возможным транслокацию NF-κB в ядро и активацию транскрипции эффекторных генов (например, IL-8). Пробиотические бактерии, такие как Lactobacilli, способны модулировать активность Ub-протеасомной системы, индуцируя продукцию активных форм кислорода (АФК) в эпителиальных клетках. В клетках млекопитающих АФК, как было показано, служат важными вторичными посредниками в множественных путях передачи сигналов в ответ на провоспалительные цитокины. Бактериально индуцированные АФК вызывают окислительную инактивацию каталитического цистеинового остатка Ub 12, что приводит к неполной, но временной потере недилирования куллина-1 и последующему влиянию на передачу сигналов NF-κB и β-катенина. Другой вид комменсалов, B. thetaiotaomicron, ослабляет экспрессию провоспалительных цитокинов, способствуя ядерному экспорту NF-κB субъединицы RelA через пероксисоединение Me, активируемый пролифератором рецептор γ (PPAR-γ) -зависимый путь. PPAR-γ нацелен на транскрипционно активный Rel A и вызывает ранний ядерный клиренс, ограничивая продолжительность действия NF-κB.
Баланс между патогенами и комменсалами чрезвычайно важен для поддержания гомеостаза в дыхательных путях.
Дыхательные пути постоянно подвергаются воздействию множества микроорганизмов, некоторые из которых способны сохраняться и даже колонизировать дыхательные пути. Это возможно благодаря наличию питательных веществ, кислорода и оптимальной температуре роста. Существует несколько источников питательных веществ для микробных жителей: секреты эпителиальных клеток дыхательных путей (особенно бокаловидные клетки), секреты подслизистых желез и транссудат из плазмы. Более того, запас доступных питательных веществ увеличивается за счет деятельности некоторых членов микробиоты. Макромолекулярные компоненты респираторного секрета (белки, гликопротеины, липиды, нуклеиновые кислоты) превращаются в питательные вещества (например, углеводы, аминокислоты). Таким образом, метаболическая активность существующих бактерий позволяет колонизировать новые виды. Комменсальные бактерии непатогены и защищают наши дыхательные пути от патогенов. Есть несколько возможных механизмов. Комменсалы - местные конкуренты патогенных бактерий, потому что они, как правило, занимают одну и ту же экологическую нишу внутри человеческого тела. Во-вторых, они способны производить антибактериальные вещества, называемые бактериоцинами, которые подавляют рост патогенов.
Роды Bacillus, Lactobacillus, Lactococcus, Staphylococcus, Streptococcus и Streptomyces являются основными продуцентами бактериоцинов в дыхательных путях. Кроме того, известно, что комменсалы вызывают ответ Th1 и выработку противовоспалительного интерлейкина (IL) -10, антимикробных пептидов, FOXP3, секреторного иммуноглобулина A (sIgA).
 Экологическое моделирование респираторного микробиома.
Экологическое моделирование респираторного микробиома. Изменения в составе микробного сообщества, по-видимому, играют роль в прогрессировании таких легочных заболеваний, как хроническая обструктивная болезнь легких (ХОБЛ), астма и муковисцидоз. У людей S. aureus является частью нормальной микробиоты верхних дыхательных путей, кожи и слизистой оболочки кишечника. S. aureus, наряду с подобными видами, которые могут колонизировать и действовать симбиотически, но могут вызывать заболевание, если они начинают захватывать ткани, которые они колонизировали, или вторгаются в другие ткани, были названы «патобионтами». Точно так же MRSA может колонизировать людей, не вызывая у них болезней. Наличие таких родов, как Mycoplasma, Pseudomonas и Staphylococcus коррелирует со стабильным состоянием ХОБЛ. С другой стороны, Prevotella, Mesorhizobium, Microbacterium, Micrococcus, Veillonela, Rhizobium, Stenotrophomonas и Lactococcus присутствуют в основном в когорте здоровых людей. Относительное количество протеобактерий увеличивается у детей-астматиков. Pseudomonas aeruginosa, Staphylococcus aureus и Burkholderia cepacia чаще всего обнаруживаются у пациентов с муковисцидозом.
Подходы к высокопроизводительному секвенированию и секвенированию всего генома предоставят дополнительную информацию о сложности и физиологическом значении комменсальных бактерий в нижних дыхательных путях.