RIG-I-подобный рецептор (рецепторы, индуцируемые ретиноевой кислотой, ген I-подобные, RLR ) представляют собой тип внутриклеточного рецептора распознавания образов, участвующего в распознавании вирусов врожденной иммунной системой. RIG-I (ген I, индуцируемый ретиноевой кислотой, также известный как DDX58) является наиболее охарактеризованным рецептором в семействе RIG-I-подобных рецепторов (RLR). Вместе с MDA5 (связанная с дифференцировкой меланомы 5) и LGP2 (лаборатория генетики и физиологии 2) это семейство рецепторов распознавания цитоплазматических паттернов (PRR) является дозорным для внутриклеточной вирусной РНК, которая продукт вирусной инфекции. Рецепторы RLR обеспечивают передовую защиту от вирусных инфекций в большинстве тканей.
Рецептор RIG-I предпочитает короткое связывание (<2000 bp) single- or double-stranded РНК, несущая не закрытый 5'-трифосфат и дополнительные мотивы такие как мотивы РНК, богатые полиуридином. RIG-I вызывает иммунный ответ на РНК-вирусы из различных семейств, включая парамиксовирусы (например, корь), рабдовирусы (например, вирус везикулярного стоматита) и ортомиксовирусы (например, гриппа A ). лиганды MDA5 плохо охарактеризованы, но предпочтение отдается длинной двухцепочечной РНК (>2000 п.н.), например репликативная форма РНК пикорнавируса, которая обнаруживается в клетках, инфицированных пикорнавирусом. LGP2 связывается с двухцепочечной РНК с тупым концом переменной длины, а также с РНК -связанный MDA5 для регулирования образования филамента. T последнее связано с распознаванием LGP2 пикорнавирусов (например, вирус энцефаломиокардита), согласно MDA5.
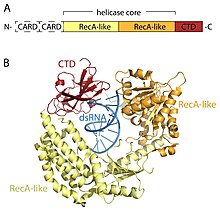 Доменная архитектура RIG-I. (A) Схематическое изображение полноразмерного RIG-I. (B) Рентгеновская кристаллическая структура РНК-связанного RIG-I (PDB : 2YKG ), за исключением доменов CARD.
Доменная архитектура RIG-I. (A) Схематическое изображение полноразмерного RIG-I. (B) Рентгеновская кристаллическая структура РНК-связанного RIG-I (PDB : 2YKG ), за исключением доменов CARD. Рецепторы RLR являются членами DEAD-box (SF2) геликазное семейство (несмотря на то, что оно содержит мотив DExD / H, а не характерный для этого семейства мотив DEAD) и имеют общую архитектуру домена. Все содержат каталитическое ядро геликазы, состоящее из двух RecA-подобных доменов. Ядро каталитической геликазы содержит по крайней мере 9 высококонсервативных мотивов последовательности, которые координируют связывание АТФ и РНК и гидролиз АТФ для раскручивания РНК. С-концевой домен (CTD; InterPro : IPR021673 ) следует за ядром геликазы, и этот домен также связывает вирусную РНК. Четкие петли связывания РНК внутри CTD трех RLR определяют тип РНК, с которой они могут связываться. В дополнение к ядру геликазы и CTD, RIG-I и MDA5 имеют две N-концевые CARD (домены рекрутирования активных каспаз ), которые необходимы для инициации нижестоящей передачи сигналов. LGP2 отличается как от RIG-I, так и от MDA5, поскольку в нем отсутствуют сигнальные домены CARD, и вместо этого он участвует в качестве положительного и отрицательного регулятора RIG-I и MDA5.
В Неинфицированные клетки, в которых отсутствует вирусная РНК RIG-I, существуют в неактивной конформации, в которой домены CARD замаскированы из-за их взаимодействия с CTD. После связывания РНК, RIG-I переходит в конформацию, в которой домены CARD открыты и «доступны» для передачи сигналов. Напротив, картам MDA5 CARD не мешает отсутствие вирусной РНК. В качестве защиты для активации RLR экспонированные RIG-I и MDA5 CARD могут претерпевать посттрансляционные модификации (например, убиквитинирование, фосфорилирование ), которые либо положительно, либо отрицательно регулируют нижестоящую передачу сигналов.
 Схема передачи сигнала RLR. Ub обозначает убиквитинирование, P обозначает фосфорилирование.
Схема передачи сигнала RLR. Ub обозначает убиквитинирование, P обозначает фосфорилирование.В активированном состоянии экспонированные домены RIG-I CARD взаимодействуют с доменами CARD MAVS (митохондриальный антивирусный сигнальный белок, также известный как IPS-1, VISA или Cardif), который находится на внешней поверхности митохондрий. Это событие связывания важно для передачи сигналов, поскольку оно заставляет MAVS образовывать большие функциональные агрегаты, в которых TRAF3 (фактор 3, связанный с рецептором TNF), а затем IKKε / TBK1 (I-каппа-B киназа-эпсилон / TANK-связывающая киназа 1) задействованы. Комплекс IKKε / TBK1 приводит к активации факторов транскрипции регуляторного фактора интерферона 3 (IRF3) и IRF7, которые индуцируют тип I (включая IFNα и IFNβ ) и интерфероны типа III (IFN). IFN типа I связывают рецепторы IFN типа I на поверхности клетки, которая их продуцирует, а также другие типы клеток, которые экспрессируют рецептор, чтобы активировать JAK-STAT (киназа Janus / преобразователи сигналов и активаторы транскрипции).) сигнализация. Это приводит к индукции сотен (ISG), которые усиливают ответ IFN. В целом это вызывает гибель инфицированных клеток, защиту окружающих клеток и активацию антиген-специфического противовирусного иммунного ответа. В совокупности этот скоординированный противовирусный иммунный ответ контролирует вирусную инфекцию.
Поскольку пролонгированная продукция IFN связана с заболеванием человека, передача сигналов RLR должна строго регулироваться. Одним из различных способов достижения этого является посттрансляционная модификация или мечение сигнальных белков RLR хозяина фосфатом (известное как фосфорилирование ) или убиквитин (известное как убиквитинирование). Эти теги также могут быть удалены, что добавляет дополнительный регуляторный уровень к передаче сигналов RLR. Эти посттрансляционные модификации и их удаление преобладают в передаче сигналов RLR и даже регулируют сам рецептор RIG-I. Наиболее известно, что домен RIG-I CARD фосфорилируется протеинкиназой C -α (PKC-α) и PKC-β в состоянии покоя, чтобы негативно регулировать передачу сигналов. При вирусной инфекции RIG-I дефосфорилируется с помощью PP1α и PP1γ, что делает возможным убиквитинирование домена RIG-I CARD лигазой E3 TRIM25 для активации противовирусного иммунного ответа, опосредованного RLR. Учитывая, что посттрансляционные модификации настолько важны для активации передачи сигналов RLR, неудивительно, что они прямо или косвенно нацелены на такие вирусы, как грипп A и корь, соответственно, для подавления передачи сигналов.
Вирусы разработали способы нарушить передачу сигналов RLR, чтобы повысить свою выживаемость. Например, вирус гриппа A и вирус Западного Нила (WNV) используют свои белки NS1 (неструктурный белок 1), чтобы блокировать убиквитинирование RIG-I с помощью TRIM25 или вызывать деградацию RIG-I, соответственно, что, в свою очередь, ингибирует продукцию IFN. Этот результат также достигается с помощью белка NS3 / 4A гепатита C (HCV) путем расщепления части MAVS и лидерной протеазы вируса ящура (FMDV) ( Lpro), который расщепляет LGP2. Аналогичным образом, вирус денге (DENV) использует свои белки NS2B3, NS2A и NS4B для связывания IKKε и предотвращения фосфорилирования IRF3 и его белка NS4A, согласно вирусу Зика, чтобы связывать MAVS и блокировать Связывание с рецептором RLR. Другим ярким примером являются белки парамиксовируса V, которые напрямую связывают различные RLR или сигнальные белки, расположенные ниже по течению, включая MDA5, LGP2 и STAT, или белки, такие как PP1α и PP1γ, которые негативно регулируют передачу сигналов RLR.
![]() Эта статья была адаптирована из следующего источника по лицензии CC BY 4.0 () (отчеты рецензента ): Натали А. Борг (2019), «RIG-I like рецепторы», WikiJournal of Science, 2 (1): 1, doi : 10.15347 / WJS / 2019.001, Wikidata Q62604415
Эта статья была адаптирована из следующего источника по лицензии CC BY 4.0 () (отчеты рецензента ): Натали А. Борг (2019), «RIG-I like рецепторы», WikiJournal of Science, 2 (1): 1, doi : 10.15347 / WJS / 2019.001, Wikidata Q62604415