Анализ взаимодействия хроматина путем секвенирования парных конечных тегов (ChIA-PET или ChIA-PETS ) - это метод, который включает обогащение на основе иммунопреципитации хроматина (ChIP), парные концевые теги и высокопроизводительное секвенирование для определять de novo дальнодействующие взаимодействия хроматина в масштабе всего генома.
Гены могут регулироваться областями, удаленными от промотора, такими как регуляторные элементы, инсуляторы и граничные элементы, и сайты связывания факторов транскрипции (TFBS). Выявление взаимодействия между регуляторными регионами и кодирующими областями генов необходимо для понимания механизмов, управляющих генной регуляцией при здоровье и заболевании. (Мастон и др., 2006). ChIA-PET может быть использован для идентификации уникальных функциональных взаимодействий хроматина между дистальными и проксимальными регулирующими сайтами связывания факторов транскрипции и промоторами генов, с которыми они взаимодействуют.
ChIA-PET может также использоваться для раскрытия механизмов контроля генома во время таких процессов, как дифференцировка клеток, пролиферация и развитие. Путем создания карт взаимодействия ChIA-PET для ДНК-связывающих регуляторных белков и промоторных областей мы можем лучше идентифицировать уникальные мишени для терапевтического вмешательства (Fullwood Yijun, 2009).
Метод ChIA-PET сочетает в себе методы на основе ChIP (Kuo Allis, 1999) и захват конформации хромосомы (3C), чтобы расширить возможности обоих подходов. ChIP-Sequencing (ChIP-Seq) - популярный метод, используемый для идентификации TFBS, тогда как 3C используется для идентификации дальнодействующих взаимодействий хроматина (Dekker et al., 2002). Тем не менее, оба имеют ограничения при использовании независимо друг от друга для выявления дальнодействующих взаимодействий de novo в масштабе всего генома. Хотя ChIP-Seq обычно используется для полногеномной идентификации TFBS (Barski et al., 2007; Wei et al., 2006), он предоставляет только линейную информацию о сайтах связывания белков вдоль хромосом (но не о взаимодействиях между ними), и может страдать от высокого геномного фонового шума (ложные срабатывания).
Хотя 3C способен анализировать дальнодействующие взаимодействия хроматина, он не может использоваться в масштабах всего генома и, как ChIP-Seq, также страдает от высоких уровней фонового шума. Поскольку шум увеличивается в зависимости от расстояния между взаимодействующими регионами (макс. 100kb), требуются трудоемкие и утомительные средства контроля для точной характеристики взаимодействий хроматина (Dekker et al., 2006).
Метод ChIA-PET успешно решает проблемы неспецифического шума взаимодействия, обнаруженного в ChIP-Seq, путем обработки фрагментов ChIP ультразвуком для отделения случайных присоединений от конкретных комплексов взаимодействия. Следующий шаг, который называется обогащением, снижает сложность анализа в масштабе всего генома и добавляет специфичности взаимодействиям хроматина, связанным с заранее определенными TF (факторами транскрипции). Способность подходов 3C определять дальнодействующие взаимодействия основана на теории лигирования близости. Что касается интерлигирования ДНК, фрагменты, которые связаны общими белковыми комплексами, имеют большие кинетические преимущества в условиях разбавления, чем фрагменты, свободно диффундирующие в растворе или закрепленные в различных комплексах. ChIA-PET использует преимущества этой концепции путем включения линкерных последовательностей на свободные концы фрагментов ДНК, связанных с белковыми комплексами. Для создания связности фрагментов, связанных регуляторными комплексами, линкерные последовательности лигируют во время лигирования ядерной близости. Следовательно, продукты лигирования с линкерным соединением могут быть проанализированы с помощью секвенирования ПЭТ со сверхвысокой пропускной способностью и сопоставлены с эталонным геномом. Поскольку ChIA-PET не зависит от специфических сайтов для обнаружения, как 3C и 4C, он позволяет беспристрастное, общегеномное обнаружение взаимодействий хроматина de-novo (Fullwood et al., 2009).
Часть рабочего процесса «влажная лаборатория»:
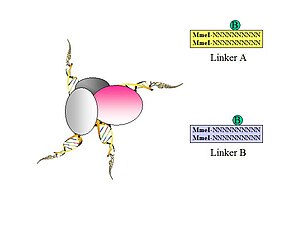 Рис. 1. Вводятся биотинилированные универсальные линкеры с сайтами рестрикционных эндонуклеаз Mme1.
Рис. 1. Вводятся биотинилированные универсальные линкеры с сайтами рестрикционных эндонуклеаз Mme1.  Рис. 2. Биотинилированные универсальные линкеры лигируются со свободной ДНК заканчивается.
Рис. 2. Биотинилированные универсальные линкеры лигируются со свободной ДНК заканчивается. 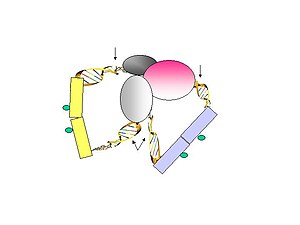 Рисунок 3. Лигирование линкеров во время бесконтактного лигирования.
Рисунок 3. Лигирование линкеров во время бесконтактного лигирования.  Рисунок 4. Удаление биотинилированных линкеров стрептавидиновыми гранулами и амплификация ДНК-меток.
Рисунок 4. Удаление биотинилированных линкеров стрептавидиновыми гранулами и амплификация ДНК-меток.  Рисунок 5. Конформации универсальных линкеров.
Рисунок 5. Конформации универсальных линкеров. Часть рабочего процесса в сухой лаборатории:
ПЭТ-экстракция, картирование и статистический анализ
ПЭТ-теги извлекаются и сопоставлен с эталонным геномом человека in silico.
Идентификация пиков (сайтов связывания), обогащенных ChIP.
Самолигирующийся ПЭТ используется для идентификации сайтов, обогащенных ChIP, поскольку они обеспечивают наиболее надежное отображение (20 + 20 бит / с) на эталонный геном.
Алгоритм обнаружения пика обогащения ChIP
Вызванный пик считается сайтом связывания, если имеется несколько перекрывающихся самолигирующихся ПЭТ. Уровень ложного обнаружения (FDR) определяется с помощью статистического моделирования для оценки случайного фона перекрытий виртуальной ДНК, полученных из ПЭТ, и оцененного фонового шума.
Фильтрация повторяющейся ДНК (влияет на неспецифическое связывание)
Сателлитные области и сайты связывания, присутствующие в областях с серьезными структурными вариациями, удаляются.
Счетчик обогащения ChIP
Количество ПЭТ с самолигированием и интерлигированием (в пределах окна +250 п.н.) сообщается для каждого сайта. Общее количество самолигированных и интерлигированных ПЭТ в определенном месте называется подсчетом обогащения ChIP.
Рис. 6. Классификация ПЭТ: уникально выровненные последовательности ПЭТ можно классифицировать по тому, происходят ли они из одного фрагмента ДНК или двух фрагментов ДНК.
 Рис. 6. Внутрилигированные и лигированные ПЭТ группируются вокруг TFBS при картировании в эталонный геном человека.
Рис. 6. Внутрилигированные и лигированные ПЭТ группируются вокруг TFBS при картировании в эталонный геном человека. Если два тега ПЭТ картированы на одной хромосоме с диапазоном генома в диапазоне фрагментов ДНК ChIP (менее 3 КБ), с ожидаемой самолигированием ориентации и на одной и той же цепи, они считаются полученными в результате самолигирования одного фрагмента ДНК ChIP и считаются ПЭТ с самолигированием.
Если ПЭТ не соответствует этим критериям, то ПЭТ, скорее всего, является результатом лигирования двух фрагментов ДНК и называется ПЭТ с интерлигированием. Два тега ПЭТ с интерлигированием не имеют фиксированной ориентации тегов, могут не находиться на одних и тех же цепях, могут иметь любой геномный диапазон и могут не отображаться на одной и той же хромосоме.
Если два тега ПЭТ интерлигирования картированы в одной хромосоме, но с размахом>3 Кбайт в любой ориентации, то эти ПЭТ называют ПЭТ внутрихромосомного интерлигирования.
ПЭТ, которые картированы на разные хромосомы, называются ПЭТ с межхромосомным интерлигированием.
Рисунок 7. Предлагаемый механизм, показывающий, как дистальные регуляторные элементы могут инициировать дальнодействующие взаимодействия хроматина с участием промоторных областей генов-мишеней.
 Рисунок 7. Предлагаемый механизм образования петель ДНК между дистальными регуляторными белками и промоторной областью
Рисунок 7. Предлагаемый механизм образования петель ДНК между дистальными регуляторными белками и промоторной областью Взаимодействия образуют петлевые структуры ДНК с множеством TFBS в центре закрепления. Маленькие петли могут упаковывать гены рядом с центром закрепления в плотный субкомпартмент, что может увеличивать локальную концентрацию регуляторных белков для усиленной активации транскрипции. Этот механизм может также повышать эффективность транскрипции, позволяя РНК pol II циклически замораживать плотные кольцевые генные матрицы. Большие петли взаимодействия с большей вероятностью будут связывать вместе отдаленные гены на любом конце петли, расположенные рядом с якорными сайтами для скоординированной регуляции, или могут разделять гены в длинные петли, чтобы предотвратить их активацию. По материалам Fullwood et al. (2009).
Преимущества метода ChIA-PET
Слабые стороны
Fullwood et al. (2009) использовали ChIA-PET для обнаружения и картирования сети взаимодействия хроматина, опосредованной рецептором эстрогена альфа (ER-альфа) в раковых клетках человека. Полученная в результате глобальная карта взаимодействия хроматина показала, что удаленные сайты связывания ER-альфа также были прикреплены к промоторам генов посредством дальнодействующих взаимодействий хроматина, предполагая, что ER-альфа функционирует посредством обширного образования петель хроматина, чтобы объединить гены для координированной регуляции транскрипции.
Программное обеспечение, обычно используемое в эксперименте ChIA-PET
ELAND
Сопоставляет фрагменты ДНК, обогащенные ChIP, с эталонным геномом человека. [1]
RepeatMasker
In-silico маскирование повторяющихся элементов. [2]
Моделирование Монте-Карло
Используется для оценки частоты ложных обнаружений.
PET-Tool
Пакет программного обеспечения для обработки и управления Данные последовательности ди-тегов с парными концами. [3]
ChIA-PET Tool
Программный пакет для обработки данных ChIA-PET. Веб-сайт ChIA-PET Tool ChIA-PET Tool paper
Иммунопреципитация хроматина:
ChIP-Seq,.
захват конформации хромосомы :
2-C, 3-C, 4-C, 5-C
Теги с парным концом:
PET.