Низкокогерентная интерферометрия с угловым разрешением (a / LCI ) - это новая технология биомедицинской визуализации, которая использует свойства рассеянного света для измерения средний размер клеточных структур, включая ядра клеток. Эта технология перспективна в качестве клинического инструмента для in situ обнаружения диспластической или предраковой ткани.
A / LCI объединяет низкокогерентную интерферометрию с угловым разрешением рассеянием для решения обратной задачи определения геометрии рассеивателя на основе дифракционных картин в дальней зоне. Подобно рефлектометрии в области оптической когерентности (OCDR) и оптической когерентной томографии (OCT), a / LCI использует широкополосный источник света в схеме интерферометрии для достижения оптического секционирования с глубиной разрешение устанавливается длиной когерентности источника. Измерения рассеяния с угловым разрешением захватывают свет как функцию угла рассеяния и инвертируют углы, чтобы вывести средний размер рассеивающих объектов с помощью вычислительной модели рассеяния света, например Теория Ми, которая предсказывает углы на основе размера рассеивающей сферы. Комбинирование этих методов позволяет создать систему, которая может измерять средний размер разброса на различных глубинах в образце ткани.
В настоящее время наиболее важным медицинским применением технологии является определение состояния здоровья ткани на основе измерений среднего количества клеток. размер ядер. Было обнаружено, что когда ткань изменяется от нормальной к злокачественной, средний размер ядер клеток увеличивается. Несколько недавних исследований показали, что с помощью измерений ядер клеток a / LCI может обнаруживать дисплазию низкой и высокой степени с чувствительностью 91% и различать нормальную и диспластическую с точностью 97%.
С 2000 года системы светорассеивания использовались для биомедицинских приложений, таких как исследование клеточной морфологии, а также для диагностики дисплазии. Вариации в распределении рассеяния в зависимости от угла или длины волны использовались для вывода информации, касающейся размера клеток и субклеточных объектов, таких как ядра и органеллы. Эти измерения размеров затем могут быть использованы диагностически для обнаружения изменений ткани, включая неопластические изменения (те, которые приводят к раку).
Спектроскопия светорассеяния использовалась для обнаружения дисплазии в толстой кишке, мочевом пузыре, шейке матки и пищеводе пациенты-люди. Рассеяние света также использовалось для обнаружения пищевода Барретта, метапластического состояния с высокой вероятностью приводящего к дисплазии.
Однако, в отличие от a / LCI, все эти методы полагаются на общую измерения на основе интенсивности, которые не позволяют получить результаты в зависимости от глубины в ткани.
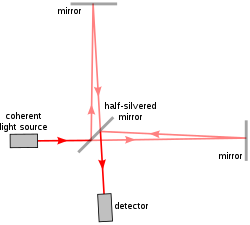 Путь света в интерферометре Майкельсона.
Путь света в интерферометре Майкельсона. В первой реализации a / LCI использовался интерферометр Майкельсона, та же модель использовалась в знаменитом эксперименте Майкельсона – Морли. Интерферометр Майкельсона разделяет один луч света на два пути, один эталонный путь и один путь дискретизации, и снова рекомбинирует их, чтобы получить форму волны, возникающую в результате интерференции. Таким образом, разница между эталонным лучом и лучом для отбора проб показывает свойства образца в том, как он рассеивает свет.
Ранний а / LCI устройство, используемое подвижное зеркало и линзы в опорном плече так, чтобы исследователи могли воспроизвести различные углы и глубины в эталонный пучок, как они имели место в собранном обратнорассеянного свете. Это позволяло изолировать обратно рассеянный свет на различной глубине отражения в образце. Чтобы преобразовать данные в измерения структуры ячеек, распределения углового рассеяния затем сравниваются с предсказаниями теории Ми, которая вычисляет размер сфер относительно их структуры рассеяния света.
Метод a / LCI был впервые подтвержден при исследованиях полистирольных микросфер, размеры которых были известны и относительно однородны. Более позднее исследование расширило метод обработки сигналов, чтобы компенсировать несферическую и неоднородную природу клеточных ядер.
Эта ранняя система требовала до 40 минут для сбора данных для точки 1 мм² в образце, но доказала свою эффективность. осуществимость идеи.
 Примеры результатов a / LCI в области Фурье
Примеры результатов a / LCI в области Фурье Как и OCT, ранние реализации a / LCI основывались на физическом изменении длины оптического пути ( OPL), чтобы контролировать глубину в выборке, из которой собираются данные. Однако было продемонстрировано, что можно использовать реализацию области Фурье для получения разрешения по глубине за один сбор данных. широкополосный источник света используется для одновременного получения спектра длин волн, а обратно рассеянный свет собирается когерентным оптическим волокном на обратном пути для захвата разные углы рассеяния одновременно. Затем интенсивность измеряется с помощью спектрометра : один кадр из спектрометра содержит интенсивность рассеяния как функцию от длины волны и угла. Наконец, данные подвергаются преобразованию Фурье построчно для получения интенсивности рассеяния как функции OPL и угла. В результирующем изображении ось x представляет собой OPL, а ось y - угол отражения, что дает двумерную карту интенсивности отражения.
При использовании этого метода скорость сбора данных ограничивается только временем интегрирования спектрометра и может составлять всего 20 мс. Те же данные, для сбора которых изначально требовались десятки минут, могут быть получены в ~ 10 раз быстрее.
 Схема системы / LCI. Свет обеспечивается SLD, образец и эталонный свет генерируются волоконным делителем (FS), а линзы L2, L3 и L4 обеспечивают коллимацию. Светоделитель (BS) объединяет свет образца и эталонного плеча, который затем падает на формирующий изображение спектрометр. Справа: оптическая геометрия наконечника зонда с освещающим волокном (DF), линзой L1 и собирающим волокном (FB).
Схема системы / LCI. Свет обеспечивается SLD, образец и эталонный свет генерируются волоконным делителем (FS), а линзы L2, L3 и L4 обеспечивают коллимацию. Светоделитель (BS) объединяет свет образца и эталонного плеча, который затем падает на формирующий изображение спектрометр. Справа: оптическая геометрия наконечника зонда с освещающим волокном (DF), линзой L1 и собирающим волокном (FB). В версии системы a / LCI в Фурье-области используется суперлюминесцентный диод (SLD) с волоконно-оптическим выходом в качестве источника света. Волоконный разветвитель разделяет путь прохождения сигнала с интенсивностью 90% и опорный тракт с интенсивностью 10%.
Свет от SLD проходит через оптический изолятор , а затем через контроллер поляризации. Было показано, что контроль поляризации света важен для максимизации оптического сигнала и сравнения углового рассеяния с моделью рассеяния Ми. Для передачи света к образцу используется поддерживающее поляризацию волокно. Второй контроллер поляризации аналогичным образом используется для управления поляризацией света, проходящего через опорный путь.
Выход волокна справа коллимирован с помощью линзы L1 и освещает ткань. Но поскольку волокно доставки смещено от оптической оси линзы, луч доставляется к образцу под косым углом. Затем обратно рассеянный свет коллимируется той же линзой и собирается пучком волокон. Волокна находятся на расстоянии одного фокусного расстояния от линзы, а образец - на одном фокусном расстоянии с другой стороны. Эта конфигурация захватывает свет с максимального диапазона углов и сводит к минимуму световой шум из-за зеркальных отражений.
На дистальном конце жгута волокон свет от каждого волокна отображается на спектрометре. Свет от образца и эталонного плеча смешивается с помощью светоделительного куба (BS) и падает на входную щель спектрометра формирования изображений. Данные со спектрометра изображения передаются в компьютер через интерфейс универсальной последовательной шины для обработки сигналов и отображения результатов. Компьютер также обеспечивает управление спектрометром изображений.
 Изображение портативной системы A / LCI с переносным оптоволоконным датчиком справа и оптическим механизмом слева. Компьютер не показан.
Изображение портативной системы A / LCI с переносным оптоволоконным датчиком справа и оптическим механизмом слева. Компьютер не показан. Система a / LCI недавно была усовершенствована и теперь позволяет работать в клинических условиях с добавлением портативной палочки. Тщательно контролируя поляризацию в оптоволокне доставки, используя волокна, сохраняющие поляризацию, и линейные поляризаторы, новая система позволяет манипулировать портативной палочкой без ухудшения сигнала из-за эффектов двойного лучепреломления. Кроме того, в новой системе в наконечнике зонда использовалась шариковая линза с антибликовым покрытием, которая уменьшает отражения, которые в противном случае ограничивают диапазон глубины системы.
Портативная система использует оптическую макетную плату 2 фута на 2 фута в качестве основания, с источником, оптоволоконными компонентами, линзой, светоделителем и спектрометром формирования изображений, установленными на макетной плате. Алюминиевая крышка защищает оптику. Волоконный зонд с ручным зондом обеспечивает легкий доступ к образцам тканей для тестирования. С левой стороны находится белая платформа для образцов, куда помещается ткань для тестирования. Переносной зонд используется оператором для выбора определенных участков ткани, из которых собираются показания A / LCI.