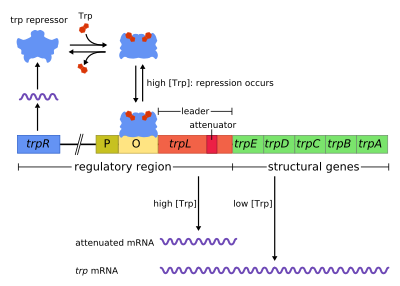
 Структура оперона trp
Структура оперона trp Оперон trp представляет собой оперон - группу генов, которые используются или транскрибируются вместе, - который кодирует компоненты для производства триптофана. Оперон trp присутствует во многих бактериях, но впервые был охарактеризован у Escherichia coli. Оперон регулируется таким образом, что, когда триптофан присутствует в окружающей среде, гены синтеза триптофана не экспрессируются. Это была важная экспериментальная система для изучения регуляции генов, и она обычно используется для обучения регуляции генов.
Оперон Trp содержит пять структурных генов: trpE, trpD, trpC, trpB и trpA, которые кодируют ферментативные части пути. Он также содержит репрессивный регуляторный ген, называемый trpR. trpR имеет промотор, где РНК-полимераза связывает и синтезирует мРНК для регуляторного белка. Белок, синтезируемый trpR, затем связывается с оператором , который затем вызывает блокировку транскрипции. В опероне trp триптофан связывается с репрессорным белком, эффективно блокируя транскрипцию гена. В этой ситуации репрессия - это репрессия РНК-полимеразы, транскрибирующей гены оперона. Также в отличие от lac-оперона, trp-оперон содержит лидерный пептид и последовательность аттенюатора, которая допускает постепенную регуляцию.
Это пример репрессируемого отрицательная регуляция экспрессии гена. В регуляторной последовательности оперона оператор связывается с репрессорным белком в присутствии триптофана (тем самым предотвращая транскрипцию ) и высвобождается в отсутствие триптофана (тем самым разрешение транскрипции).
Оперон Trp содержит пять структурных генов. Их роли:
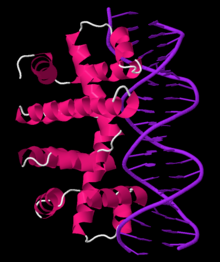 Димер репрессора Trp, связанный с операторной ДНК
Димер репрессора Trp, связанный с операторной ДНК оперон действует посредством механизма отрицательной репрессируемой обратной связи. Репрессор для оперона trp продуцируется перед геном trpR, который конститутивно экспрессируется на низком уровне. Синтезированные мономеры trpR объединяются в димеры. Когда присутствует триптофан, эти димеры репрессора триптофана связываются с триптофаном, вызывая изменение конформации репрессора, позволяя репрессору связываться с оператором . Это предотвращает связывание РНК-полимеразы с опероном и его транскрипцию, поэтому триптофан не вырабатывается из его предшественника. Когда триптофан отсутствует, репрессор находится в неактивной конформации и не может связываться с областью оператора, поэтому транскрипция не ингибируется репрессором.
 Механизм ослабления транскрипции оперона trp.
Механизм ослабления транскрипции оперона trp. Аттенюация - второй механизм отрицательной обратной связи в опероне trp. Система репрессии нацелена на внутриклеточную концентрацию trp, тогда как ослабление реагирует на концентрацию заряженной тРНК. Таким образом, репрессор trpR снижает экспрессию гена, изменяя инициацию транскрипции, в то время как аттенуация делает это, изменяя процесс транскрипции, который уже выполняется. В то время как репрессор TrpR снижает транскрипцию в 70 раз, аттенуация может дополнительно уменьшить ее в 10 раз, что позволяет накопить репрессию примерно в 700 раз. Ослабление стало возможным благодаря тому факту, что у прокариот (у которых нет ядра ) рибосомы начинают транслировать мРНК в то время как РНК-полимераза все еще транскрибирует последовательность ДНК. Это позволяет процессу трансляции напрямую влиять на транскрипцию оперона.
В начале транскрибируемых генов оперона trp находится последовательность из по меньшей мере 130 нуклеотидов, называемая лидерным транскриптом (trpL; P0AD92 ). Ли и Янофски (1977) обнаружили, что эффективность ослабления коррелирует со стабильностью вторичной структуры, встроенной в trpL, и 2 составляющие шпильки структуры терминатора были позже выяснены Oxender et al. (1979). Этот транскрипт включает четыре короткие последовательности, обозначенные 1–4, каждая из которых частично комплементарна следующей. Таким образом, могут образовываться три отдельные вторичные структуры (шпильки ): 1–2, 2–3 или 3–4. Гибридизация последовательностей 1 и 2 с образованием структуры 1–2 происходит редко, потому что РНК-полимераза ожидает присоединения рибосомы, прежде чем продолжить транскрипцию после последовательности 1, однако, если шпилька 1–2 образовалась, это предотвратило бы образование 2–3 строение (но не 3–4). Образование шпилечной петли между последовательностями 2–3 предотвращает образование шпилечной петли между последовательностями 1-2 и 3-4. Структура 3–4 представляет собой последовательность терминации транскрипции (в большом количестве в G / C и сразу за ней следуют несколько остатков урацила), как только она образуется, РНК-полимераза отделяется от ДНК и транскрипция структурных генов оперона не может произойти (более подробное объяснение см. ниже). Функциональное значение второй шпильки для терминации транскрипции иллюстрируется сниженной частотой терминации транскрипции, наблюдаемой в экспериментах, дестабилизирующих центральное спаривание G + C этой шпильки.
Часть лидерного транскрипта кодирует короткое полипептид из 14 аминокислот, называемый лидерным пептидом. Этот пептид содержит два соседних остатка триптофана, что необычно, поскольку триптофан - довольно необычная аминокислота (примерно один из ста остатков в типичном белке E. coli - триптофан). Нить 1 в trpL охватывает область, кодирующую концевые остатки лидерного пептида: Trp, Trp, Arg, Thr, Ser; Консервация наблюдается в этих 5 кодонах, тогда как мутация вышестоящих кодонов не изменяет экспрессию оперона. Если рибосома пытается транслировать этот пептид, в то время как уровни триптофана в клетке низкие, она остановится на любом из двух кодонов trp. Во время остановки рибосома физически экранирует последовательность 1 транскрипта, предотвращая образование вторичной структуры 1-2. Последовательность 2 затем может свободно гибридизоваться с последовательностью 3 с образованием структуры 2–3, которая затем предотвращает образование шпильки с концевым концом 3–4, поэтому структура 2–3 называется шпилькой с концевым концом. При наличии структуры 2–3 РНК-полимераза может продолжать транскрибировать оперон. Мутационный анализ и исследования с участием комплементарных олигонуклеотидов демонстрируют, что стабильность структуры 2–3 соответствует уровню экспрессии оперона. Если уровни триптофана в клетке высоки, рибосома будет транслировать весь лидерный пептид без прерывания и остановится только во время завершения трансляции на стоп-кодоне. В этот момент рибосома физически экранирует обе последовательности 1 и 2. Последовательности 3 и 4, таким образом, могут свободно образовывать структуру 3–4, которая завершает транскрипцию. Эта терминаторная структура формируется, когда ни одна рибосома не останавливается в непосредственной близости от тандема Trp (т.е. кодона Trp или Arg): либо лидерный пептид не транслируется, либо трансляция проходит плавно вдоль цепи 1 с обильно заряженной tRNAtrp. Более того, предполагается, что рибосома блокирует только около 10 нт ниже по течению, таким образом, остановка рибосомы либо в вышестоящем Gly, либо в нижележащем Thr, по-видимому, не влияет на формирование терминальной шпильки. Конечным результатом является то, что оперон будет транскрибироваться только тогда, когда триптофан недоступен для рибосомы, в то время как транскрипт trpL экспрессируется конститутивно.
Этот механизм ослабления подтвержден экспериментально. Во-первых, прямо доказано, что трансляция лидерного пептида и задержка рибосом необходимы для ингибирования терминации транскрипции. Более того, мутационный анализ, дестабилизирующий или нарушающий спаривание оснований шпильки-антитерминатора, приводит к усилению терминации нескольких складок; в соответствии с моделью ослабления, эта мутация не может уменьшить ослабление даже при голодании Trp. Напротив, комплементарные олигонуклеотиды, нацеленные на цепь 1, увеличивают экспрессию оперона, способствуя образованию антитерминатора. Более того, в гистидиновом опероне компенсаторная мутация показывает, что спаривающая способность нитей 2–3 имеет большее значение, чем их первичная последовательность в ингибировании аттенуации.
При аттенюации, когда транслирующая рибосома останавливается, определяет, будет ли терминальная шпилька сформирован. Для того чтобы транскрибирующая полимераза одновременно захватила альтернативную структуру, временной масштаб структурной модуляции должен быть сопоставим с масштабом транскрипции. Чтобы гарантировать, что рибосома связывается и начинает трансляцию лидерного транскрипта сразу после его синтеза, в последовательности trpL существует сайт паузы. Достигнув этого сайта, РНК-полимераза приостанавливает транскрипцию и, по-видимому, ожидает начала трансляции. Этот механизм позволяет синхронизировать транскрипцию и трансляцию, ключевой элемент ослабления.
Подобный механизм ослабления регулирует синтез гистидина, фенилаланина и треонина.
Гены оперона Trp расположены в том же порядке в E. coli и Bacillus subtilis. Регуляция оперонов trp у обоих организмов зависит от количества trp, присутствующего в клетке. Однако первичная регуляция биосинтеза триптофана у B. subtilis осуществляется посредством ослабления, а не репрессии транскрипции. В B. subtilis триптофан связывается с одиннадцатимпонентным триптофаном-активируемым РНК-связывающим белком ослабления (TRAP), который активирует способность TRAP связываться с лидерной РНК trp. Связывание trp-активированного TRAP с лидерной РНК приводит к образованию терминаторной структуры, которая вызывает терминацию транскрипции.