 | |
| Имена | |
|---|---|
| Название IUPAC Трифторметанол | |
| Другие названия Трифторметиловый спирт, перфторметанол | |
| Идентификаторы | |
| Номер CAS | |
| 3D-модель (JSmol ) | |
| ChemSpider | |
| PubChem CID | |
| CompTox Dashboard (EPA ) | |
InChI
| |
УЛЫБКА
| |
| Свойства | |
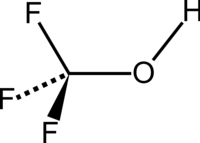
| Химическая формула | CHF 3O |
| Молярная масса | 86,013 г · моль |
| Внешний вид | Бесцветная жидкость |
| Плотность | 1,5 ± 0,1 г / см |
| Температура плавления | -110,64 |
| Точка кипения | 22,4 ° C (72,3 ° F; 295,5 K) ± 30,0 ° C |
| Опасности | |
| Температура вспышки | 18,9 ° C (66,0 ° F; 292,0 K) ± 15,6 ° |
| Если не указано иное, данные приведены для материалов в их стандартном состоянии (при 25 ° C [77 ° F], 100 кПа). | |
| Справочные данные в информационном окне | |
Трифторметанол представляет собой органическое соединение формулы CHF. 3O. Его также называют перфторметанолом или трифторметиловым спиртом. Соединение представляет собой простейший перфторированный спирт. Вещество представляет собой бесцветный газ, неустойчивый при комнатной температуре.
Как и все первичные и вторичные перфтораспирты, трифторметанол устраняет фтороводород в эндотермической реакции и образует карбонилфторид.
При температурах в диапазоне -120 ° C можно получить трифторметанол из трифторметоксихлорида и хлористого водорода :
В этой реакции рекомбинация частично положительно заряженного атома хлора (в трифторметоксихлориде) с частично отрицательно заряженным атомом хлора (в хлористом водороде) используется как элементарный хлор. Нежелательные продукты, побочные продукты хлор, хлористый водород и хлортрифторметан, можно удалить выпариванием при -110 ° C. Трифторметанол имеет точку плавления -82 ° C и расчетную температуру кипения около -20 ° C. Таким образом, температура кипения примерно на 85 К ниже, чем у метанола. Этот факт можно объяснить отсутствием внутримолекулярных связей H — F, которые также не видны в инфракрасном спектре газовой фазы.
В более простом синтезе используется реакция (I); равновесие может быть сдвинуто к термодинамически предпочтительному трифторметанолу при более низких температурах. Если синтезированный трифторметанол протонирован суперкислотами, например HSbF. 6(фторантимоновой кислотой ), равновесие можно дополнительно сместить влево в сторону желаемого продукта.
Подобно реакции (I), трифторметоксиды (CF. 3O.) можно получить из фторидов солевого типа (например, NaF) и карбонилфторида. Однако, если ион CF. 3O. находится, например, в водном растворе, замещенном кислотой, трифторметанол разлагается при комнатной температуре.
Хотя трифторметанол нестабилен при нормальных условиях, он образуется в стратосфере из радикалов CF. 3и CF. 3O. в результате реакции с OF. и радикалы F.. В этом случае разложением трифторметанола можно пренебречь в условиях, преобладающих в атмосфере, из-за высокой энергии активации реакции. Ожидаемый срок службы трифторметанола составляет несколько миллионов лет на высоте ниже 40 км.