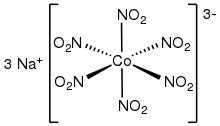
 Кобальтинитрит натрия представляет собой соль координационного комплекса [Co (NO 2) 6 ] 3-.
Кобальтинитрит натрия представляет собой соль координационного комплекса [Co (NO 2) 6 ] 3-. Комплексы переходных металлов нитрита описывают семейства координационных комплексов, содержащих один или несколько нитритных (NO 2 -) лигандов. Хотя синтетические производные представляют только научный интерес, комплексы металл-нитрит встречаются в нескольких ферментах, участвующих в азотном цикле.
 Структуры двух изомеров связи [Co (NH 3) 5 (NO 2)] 2+.
Структуры двух изомеров связи [Co (NH 3) 5 (NO 2)] 2+. Три изомера связи являются общими для нитритных лигандов: O-связанная, N-связанная и бидентатная O, O-связанная. Первые два изомера были охарактеризованы для системы пентамминкобальта (III), то есть [(NH 3) 5 Co-NO 2 ] 2+ и [(NH 3) 5 Co-ONO] 2+, называемые N-нитрито и О-нитрито соответственно. Эти две формы иногда называют нитро и нитрито. Примером хелатирующего нитрита является [Cu (bipy) 2 (O 2 N)] NO 3 - «bipy» представляет собой бидентатный лиганд 2,2'-байпиридил. Этот режим связывания иногда описывается как κ 2O, O -NO 2.
Сосредоточившись на подсчете электронов в монометаллических комплексах, O-связанные, N-связанные рассматриваются как одноэлектронные псевдогалогениды («X-лиганд»). Бидентатный O, O-связанный является «лигандом LX», родственным бидентатному карбоксилату.
Что касается теории HSAB, режим связи N более распространен для более мягких металлических центров. O- и O, O-бидентатные формы являются твердыми лигандами, обнаруженными на металлических центрах льюисовской кислоты.
Кинетически предпочтительный O-связанный изомер [(NH 3) 5 Co-ONO] 2+ превращается в [(NH 3) 5 Co-NO 2 ] 2+. В реакции с порфириновыми комплексами трехвалентного железа нитрит дает изомер с О-связью, Fe (порф) ONO. Добавление донорных лигандов к этому комплексу вызывает превращение в октаэдрический низкоспиновый изомер, который теперь представляет собой мягкую кислоту Льюиса. Нитрит изомеризуется до N-связанного изомера Fe (porph) NO 2 (L).
Изомеризация [(NH 3) 5 Co-ONO] 2+ в [(NH 3) 5 Co-NO 2 ] 2+ протекает внутримолекулярным образом.
 [Cd (NO 2) 4 ] 2- центр в виде дикалиевой соли (цветовой код: красный (O), синий (N)).
[Cd (NO 2) 4 ] 2- центр в виде дикалиевой соли (цветовой код: красный (O), синий (N)). Несколько гомолептических (комплексов только с одним видом лиганда) комплексов охарактеризованы с помощью рентгеновской кристаллографии. В инвентарь включены октаэдрические комплексы [M (NO 2) 6 ] 3- (M = Co, Rh). Плоско-квадратные гомолептические комплексы известны также для Pt (II) и Pd (II). Калиевые соли [M (NO 2) 4 ] 2- (M = An, Cd) имеют гомолептические комплексы с четырьмя O, O-бидентатными нитритными лигандами.
Традиционно нитритокомплексы металлов получают реакциями метатезиса солей или замещения лигандов с использованием солей нитритов щелочных металлов, таких как нитрит натрия. При нейтральном pH нитрит существует преимущественно в виде аниона, а не азотистой кислоты.
Нитрозильные комплексы металлов подвергаются основному гидролизу с образованием нитритных комплексов. Эта закономерность проявляется в поведении нитропруссида :
Некоторые анионные нитритокомплексы подвергаются деоксигенации под действием кислоты с образованием нитрозильного комплекса.
В некоторых случаях реакция обратима. Таким образом, можно получить нитритокомплексы путем гидролиза электрофильных нитрозилов металлов основанием.
Нитрокомплексы также катализируют окисление алкенов.
Нитритные комплексы металлов занимают видное место в азотном цикле, который описывает взаимосвязи и взаимные превращения аммиака в нитрат. Поскольку азот часто является ограничивающим питательным веществом, этот цикл важен. Сам нитрит нелегко подвергается окислительно-восстановительным реакциям, в отличие от его металлических комплексов.
Молибденсодержащий фермент нитрит-оксидоредуктаза катализирует окисление нитрита до нитрата:
Гема основанного фермент Нитрит редуктаза катализирует превращение нитрита до аммиака. Цикл начинается с восстановления комплекса железо-нитрит до нитрозильного комплекса металла.
Медьсодержащий фермент нитритредуктаза (CuNIR) катализирует одноэлектронное восстановление нитрита до оксида азота. Предлагаемый механизм влечет за собой протонирование с каппа 2О, О -NO 2 -Cu (I), комплекс. Это протонирование вызывает разрыв связи NO с образованием центра HO-Cu-ON, который имеет лиганд оксида азота, связанный О-связью с Cu (II) ( изонитрозил ).