 Общее сжатие (A) и расширение (B).
Общее сжатие (A) и расширение (B). Реакции расширения и сжатия кольца в ходе органического синтеза относятся к набору реакций, которые могут привести к расширению или сжатию существующего кольца. Это часто позволяет получить доступ к структурам, которые было бы трудно, если вообще возможно, синтезировать с помощью одиночных реакций циклизации. Расширения кольца ценны, потому что они позволяют получить доступ к более крупным системам, которые трудно синтезировать с помощью одной циклизации из-за низкой скорости образования. Усадки колец полезны для изготовления более мелких, более напряженных колец из более крупных колец. Расширения классифицируются по механизму расширения и добавленным атомам; сокращения характеризуются просто реактивным промежуточным звеном, которое выполняет сокращение.
В курсе органического синтеза химику часто нужно сформировать новое или изменить существующее кольцо. Реакции расширения и сжатия кольца используются для расширения или сжатия существующего кольца, часто делая возможным доступ к структурам, которые было бы трудно, если вообще возможно, синтезировать с помощью одиночных реакций циклизации.
Расширения цикла ценны, потому что они открывают доступ к более крупным системам, которые трудно синтезировать посредством однократной циклизации из-за медленной скорости образования (семичленные и более крупные кольца). Классификация кольцевых расширений по механизму расширения и добавленному (ым) атому (ам) позволяет увидеть сходство между различными методами расширения и разными включенными атомами. Самая широкая классификация происходит по механизму расширения. Кольца могут быть расширены путем атаки кольца на внешнюю группу, уже добавленную к кольцу (миграция / вставка), открытия велосипеда до одного большего кольца или соединения закрывающегося кольца с расширением. Эти расширения могут быть далее разбиты по типу атома, который они включают (углерод или гетероатом) в расширенное кольцо.
Внедрения углерода представляют собой чрезвычайно полезные реакции, которые вводят дополнительный атом углерода в кольцо. Эти реакции используются при синтезе многих лекарств и натуральных продуктов. Они могут осуществляться с помощью любого из механизмов, перечисленных ниже.
 Стадия миграции связи при перегруппировке пинакольного типа.
Стадия миграции связи при перегруппировке пинакольного типа. Эти реакции имеют общие черты наличия экзоциклической уходящей группы на атоме углерода, примыкающем к кольцу, и электронодонорная группа на кольце, способная инициировать миграцию эндоциклической связи.
Обычным миграционным введением углерода является пинакольная перегруппировка. Хотя эта реакция конкретно относится к вицинальной перегруппировке дигидроксида, существуют и другие перегруппировки пинакольного типа, которые протекают по тому же общему механизму, такие как перегруппировка Тиффно-Демьянова. Эти «семипинакольные перегруппировки происходят в более мягких условиях и поэтому предпочтительны в сложных синтезах. Эти реакции полезны помимо простого расширения кольца, потому что атакованная экзоциклическая группа может также иметь другие функциональные группы, присоединенные к ней, помимо уходящей группы. Группа, с которой связана эндоциклическая связь. migrates также может быть выборочно добавлен к кольцу на основе уже присутствующей функциональности, например, 1,2 присоединение в циклический кетон.
Введение углерода через отверстие в бициклической системе - это еще один способ ввести в кольцо один или несколько атомов углерода за раз. через циклопропан, содержащий бициклический промежуточный продукт, который впоследствии открывается с образованием расширенного кольца. Расширение может происходить либо через раскрытие электроциклического кольца, либо за счет индуцированного расщепления e долевая облигация.
Эти реакции различаются по способу добавления углерода для образования циклопропанового кольца. Реакция Симмонса-Смита с алкенсодержащим кольцом может быть использована для введения единственного углерода. Существуют и другие методы циклопропантации других функциональных групп, такие как расширение кольца Бюхнера для нуклеофильной атаки (A) и донорство соседней группы (B). Образование циклопропанового кольца в результате расширения одного атома углерода позволяет ввести дополнительную функциональность наряду с расширением кольца при условии, что к вставляемому углю добавлены дополнительные функции. Мишень циклопропанирования также варьируется в зависимости от используемых условий. Реакция Симмонса-Смита добавляет к алкенам, тогда как расширение кольца Бюхнера позволяет добавлять обычно нереактивные арены. Расширение кольца Бюхнера полезно, поскольку оно дает циклогептатриены в качестве продуктов с раскрытым циклом, которые находятся в ядре некоторых природных продуктов, таких как азулены. Важным соображением в этих расширениях кольца является раскрытие кольца в расширенное кольцо, а не экзоциклическая группа в исходном кольце или неоткрывающийся продукт. Расширение кольца Бюхнера поощряется к открытию желаемого продукта за счет размещения электроноакцепторных групп на добавляемом угле. Чтобы выполнить раскрытие кольца на насыщенных бициклических молекулах, циклопропан должен быть введен таким образом, чтобы соседняя группа могла способствовать расширению, или кольцо должно быть раскрыто путем атаки расширения, или кольцо должно быть раскрыто атакой со стороны внешней группы.
Размыкание кольца как средство расширения кольца также может применяться в более крупных системах, чтобы обеспечить доступ к еще большей сисциклизации кольца. В качестве примера такого расширения можно применить фрагментацию Гроба. Подобно миграции типа пинакола, фрагментация Grob опирается на группу донора электронов, которая способствует миграции связей и побуждает уходящую группу изгнаться. В этом случае электронодонорная группа может быть псевдодонорной группой, которая способна отщеплять и отдавать электронную пару в углерод с разрывом связи. Работа с двумя меньшими кольцами может позволить разработать две части молекулы отдельно перед работой с расширенным кольцом. Расширение кольца Дауда-Беквита также способно добавлять несколько атомов углерода к кольцу за раз, например, добавлять несколько атомов углерода к кольцу за раз, и является полезным инструментом для изготовления больших колец. В то время как он проходит через промежуточный бицикл, окончательная циклизация и раскрытие кольца происходят в рамках одной и той же радикальной реакции. Это расширение полезно, потому что оно позволяет расширить бета-кетоэфир до большого циклического кетона, который может быть легко получен с использованием либо циклического кетона, либо экзоциклического сложного эфира.
 Этапы миграции связи в окислении Байера-Виллигера (A) и перегруппировка Бекмана (B).
Этапы миграции связи в окислении Байера-Виллигера (A) и перегруппировка Бекмана (B). Гетероатомные присоединения к кольцам могут происходить посредством расширения кольца, если они не осуществляются посредством синтеза кольца de novo. Эти введения в основном представляют собой расширения кольца, потому что они часто происходят через пути миграции / внедрения, аналогичные тем, которые упоминались выше для углерода. Примеры включают высокоэффективные применения перегруппировки Бекмана (для введения азота в кодеин) и окисления Байера-Виллигера (введение кислорода в простые эфиры с кольцевыми клетками) в синтезе. Оба происходят с вытеснением уходящей группы, когда алкильная группа мигрирует на экзоциклический гетероатом, что поразительно похоже на перегруппировку пинакольного типа.
 Сжатие кольца за счет анионных (A), катионных (B) и карбеноидных (C) промежуточных соединений.
Сжатие кольца за счет анионных (A), катионных (B) и карбеноидных (C) промежуточных соединений. Сжатие кольца полезно для изготовления более мелких, более напряженных колец из более крупных колец. Стимул для создания этих колец исходит из трудностей, связанных с созданием полностью разработанного маленького кольца, когда такое кольцо может быть более легко изготовлено из более крупного кольца, из которого можно вырезать атом, или что исходный более крупный каркас более доступен.
Кольцевые сжатия легко охарактеризовать просто реактивным промежуточным звеном, которое выполняет сокращение. Стандартными промежуточными продуктами являются анионный, катионный и карбеноидный.
перегруппировка Фаворского является дочерним элементом анионных сокращений кольца. Он проходит через карбанион, который атакует эндоциклический углерод и вытесняет уходящую группу (галогенид), образуя бициклическую молекулу с кольцами меньшего размера, чем исходный. Затем велосипед открывается путем нуклеофильной атаки на кетон, чтобы получить сокращенный продукт.
Альтернативой стандартной перегруппировке Фаворского является выполнение того, что можно рассматривать как отрицательную пинакольную перегруппировку, когда анионная группа стимулирует связь, выровненную с уходящей группой, для миграции и вытеснения уходящей группы. группа, которая была использована в нескольких синтезах. Следует также отметить, что так называемая «квазифаворская перегруппировка» протекает без дополнительного нуклеофила с образованием конечного сокращенного продукта.
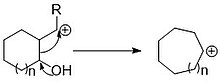
 Общая перегруппировка пинакольного типа в неравную 5,7-кольцевую систему.
Общая перегруппировка пинакольного типа в неравную 5,7-кольцевую систему. Сокращение катионной перегруппировки происходит за счет потери уходящей группы и миграции эндоциклической связи к карбокатиону. Для этого типа сокращения часто используются перегруппировки пинаколового типа. Подобно реакции расширения, это происходит с помощью донорной группы электронов, помогающей в миграции.
Реакция сжатия одного кольца может сочетаться с расширением другого, что дает неравный велосипед из сплавленного кольца одинакового размера. Эти катионные перегруппировки нашли применение для синтеза ядер сложных молекул.
Перегруппировка Вольфа может использоваться для выполнения кольцевых сокращений. Он протекает через карбеноид, образующийся при разложении диазокетона, который вставляется в углерод-углеродную связь на противоположной стороне кетона.