 | |
 | |
| Названия | |
|---|---|
| Название IUPAC оксид кобальта (II), дикобальта (III) | |
| Другие названия оксид кобальта, кобальт (II, III) оксид, оксид кобальта, четырехокись трикобальта | |
| Идентификаторы | |
| Номер CAS | |
| 3D-модель (JSmol ) | |
| ChemSpider | |
| ECHA InfoCard | 100.013.780 |
| Номер EC |
|
| PubChem CID | |
| Номер RTECS |
|
| UNII | |
| Панель управления CompTox (EPA ) | |
InChI
| |
УЛЫБКИ
| |
| Свойства | |
| Химическая формула | Co3O4. CoO.Co 2O3 |
| Молярная масса | 240. 80 г / моль |
| Внешний вид | твердое вещество черного цвета |
| Плотность | 6,07 г / см |
| Температура плавления | 895 ° C (1,643 ° F; 1168 K) |
| Точка кипения | 900 ° C (1650 ° F; 1170 K) (разлагается) |
| Растворимость в воде | Нерастворим |
| Растворимость | растворим (с разложением) в кислоты и щелочи |
| Магнитная восприимчивость (χ) | + 7380 · 10 см / моль |
| Структура | |
| Кристаллическая структура | кубическая |
| Пространственная группа | Fd3m, № 227 |
| Опасности | |
| Пиктограммы GHS |   |
| Сигнальное слово GHS | Опасно |
| Краткая характеристика опасности GHS | H317, H334, H350, H411 |
| Меры предосторожности GHS | P261, P273, P284, P304 + 340, P342 + 311 |
| NFPA 704 (огненный алмаз) |  0 2 0 0 2 0 |
| Если не указано иное, данные приведены для материалов в их стандартном состоянии (при 25 ° C [ 77 ° F], 100 кПа). | |
| Ссылки в ink | |
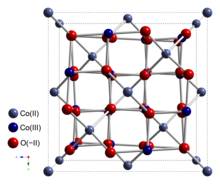
Оксид кобальта (II, III) представляет собой неорганическое соединение с помощью формулы Co3O4. Это один из двух хорошо охарактеризованных оксидов кобальта. Это черное антиферромагнитное твердое тело. Как соединение со смешанной валентностью, его формула иногда обозначается как CoCo 2O4, а иногда как CoO • Co 2O3.
Co3O4используется структура нормальной шпинели с ионами Co в тетраэдрических промежутках и ионами Co в октаэдрических промежутках кубическая плотноупакованная решетка из оксидных анионов.
 | 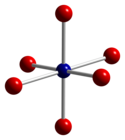 | 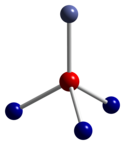 |
| тетраэдрическая координационная геометрия Co (II) | искаженная октаэдрическая координационная геометрия Co (III) | искаженная тетраэдрическая координационная геометрия O |
Оксид кобальта (II), CoO, превращается в Co 3O4при нагревании при температуре около 600 –700 ° C на воздухе. При температуре выше 900 ° C CoO стабилен. Эти реакции описываются следующим равновесием:
Оксид кобальта (II, III) используется в качестве синего красителя для керамика эмаль и стекло в качестве альтернативы оксиду кобальта (II).
Оксид кобальта (II, III) используется в качестве электрода в некоторых литий-ионные батареи, возможно, в форме наночастиц оксида кобальта.
Соединения кобальта потенциально ядовиты в больших количествах.