Фосфопротеомика - это раздел протеомики, который идентифицирует, каталогизирует и характеризует белки, содержащий фосфатную группу в качестве посттрансляционной модификации. Фосфорилирование является ключевой обратимой модификацией, которая регулирует функцию белка, субклеточную локализацию, образование комплексов, деградацию белков и, следовательно, сигнальные сети клеток. С учетом всех этих результатов модификации, по оценкам, от 30% до 65% всех белков могут фосфорилироваться, иногда несколько раз. Согласно статистическим оценкам из многих наборов данных, 230 000, 156 000 и 40 000 сайтов фосфорилирования должны существовать у человека, мыши и дрожжей соответственно.
По сравнению с анализом экспрессии, фосфопротеомика предоставляет два дополнительных уровня информации. Во-первых, он дает представление о том, какой белок или какой путь может быть активирован, потому что изменение статуса фосфорилирования почти всегда отражает изменение активности белка. Во-вторых, это указывает на то, какие белки могут быть потенциальными мишенями для лекарств, на примере ингибитора киназы Gleevec. Несмотря на то, что фосфопротеомика значительно расширит знания о количестве и типах фосфопротеинов, ее наибольшим обещанием является быстрый анализ всех сигнальных сетей на основе фосфорилирования.
Крупномасштабный фосфопротеомный анализ образца включает культивируемые клетки, подвергающиеся кодированию SILAC ; клетки стимулируются интересующим фактором (например, фактором роста, гормоном); стимуляция может происходить в течение различных периодов времени для временного анализа, клетки лизируются и ферментативно расщепляются, пептиды разделяются с использованием ионообменной хроматографии ; фосфопептиды обогащаются с использованием фосфоспецифических антител, аффинной хроматографии с иммобилизованным металлом или диоксида титана (TiO 2) хроматография ; фосфопептиды анализируются с помощью масс-спектрометрии, и пептиды секвенируются и анализируются.
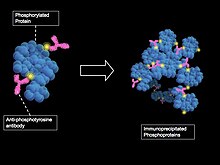 Метод очистки фосфопротеинов с помощью иммунопреципитации с антифосфотирозиновыми антителами
Метод очистки фосфопротеинов с помощью иммунопреципитации с антифосфотирозиновыми антителами Анализ всего набора фосфорилированных белков в клетке, безусловно, является возможным вариантом. Это связано с оптимизацией протоколов обогащения фосфопротеинов и фосфопептидов, улучшенными методами фракционирования с использованием хроматографии и улучшением методов выборочной визуализации фосфорилированных остатков с помощью масс-спектрометрии. Хотя текущие процедуры фосфопротеомного анализа значительно улучшены, все же происходит потеря образцов и несоответствия в отношении подготовки проб, обогащения и инструментовки. Инструменты биоинформатики и биологические исследования Базы данных quence также необходимы для высокопроизводительных фосфопротеомных исследований.
Предыдущие процедуры выделения фосфорилированных белков включали радиоактивное мечение Р-меченным АТФ с последующим электрофорезом в геле с SDS полиакриламидом или тонкослойной хроматографией. Эти традиционные методы неэффективны, поскольку невозможно получить большое количество белков, необходимых для анализа фосфорилирования. Следовательно, текущие и самые простые методы обогащения фосфопротеинов - это аффинная очистка с использованием фосфоспецифических антител, аффинная хроматография с иммобилизованным металлом (IMAC ), хроматография с сильным катионообменом (SCX) или хроматография на диоксиде титана. Доказано, что антифосфотирозиновые антитела очень успешны в очистке, но было опубликовано меньше сообщений с использованием антител против фосфосерин- или фосфотреонинсодержащих белков. Обогащение IMAC основано на сродстве фосфата к иммобилизованному металлу, хелатирующему смолу. SCX отделяет фосфорилированные пептиды от нефосфорилированных на основе отрицательно заряженной фосфатной группы. Хроматография диоксидом титана - это новый метод, который требует значительно меньше времени на подготовку колонки. Во многих фосфопротеомных исследованиях используется комбинация этих стратегий обогащения для получения максимально чистого образца.
Масс-спектрометрия в настоящее время является лучшим методом для адекватного сравнения пар образцов белка. Двумя основными процедурами для выполнения этой задачи являются использование аффинных меток с кодировкой изотопов (ICAT) и стабильных изотопных аминокислот в культуре клеток (SILAC). В процедуре ICAT образцы маркируются индивидуально после выделения с помощью реагентов с масс-кодировкой, которые модифицируют остатки цистеина. В SILAC клетки культивируют отдельно в присутствии различных меченных изотопами аминокислот для нескольких клеточных делений, позволяя клеточным белкам включать метку. Впоследствии масс-спектрометрия используется для идентификации фосфосерин, фосфотреонин и фосфотирозинсодержащих пептидов.
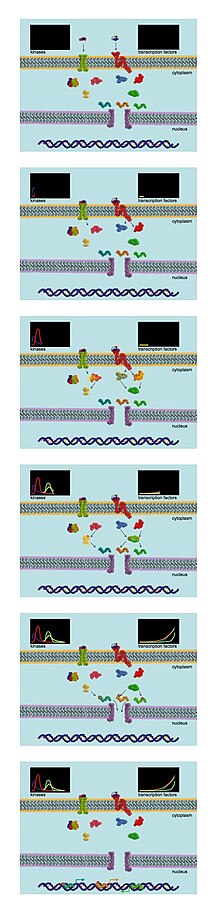 Анализ динамики передачи сигнала
Анализ динамики передачи сигнала Передача внутриклеточного сигнала в первую очередь опосредуется обратимым фосфорилированием различных сигналов. молекул ферментами, получившими название киназ. Киназы переносят фосфатные группы с АТФ на специфические сериновые, треониновые или тирозиновые остатки молекул-мишеней. Полученный фосфорилированный белок может иметь измененный уровень активности, субклеточную локализацию или третичную структуру.
Фосфопротеомные анализы идеально подходят для изучения динамики сигнальных сетей. В одном исследовании клетки подвергаются маркировке SILAC и затем стимулируются определенным фактором роста. Клетки собирают в различные моменты времени, и лизаты объединяют для анализа с помощью тандемной МС. Это позволяет экспериментаторам отслеживать состояние фосфорилирования многих фосфопротеинов в клетке с течением времени. Возможность измерения общего состояния фосфорилирования многих белков в различные моменты времени делает этот подход намного более мощным, чем традиционные биохимические методы анализа поведения сигнальной сети.
Одно исследование позволило одновременно измерить кратность изменения фосфорилирования. состояние 127 белков между нестимулированными и EphrinB1-стимулированными клетками. Из этих 127 белков 40 показали повышенное фосфорилирование при стимуляции EphrinB1. Исследователи смогли использовать эту информацию в сочетании с ранее опубликованными данными для построения сети передачи сигнала для белков, расположенных ниже рецептора EphB2.
Другое недавнее фосфопротеомное исследование включало крупномасштабную идентификацию и количественную оценку событий фосфорилирования, вызванных антидиуретическим гормоном вазопрессином в собирательном канале почек. Всего было идентифицировано 714 сайтов фосфорилирования на 223 уникальных фосфопротеинах, включая три новых сайта фосфорилирования в чувствительном к вазопрессину водном канале аквапорин-2 (AQP2).
С момента создания фосфопротеомики исследования рака были сосредоточены на изменениях фосфопротеома во время развития опухоли. Фосфопротеины могут быть маркерами рака, полезными для диагностики и лечения рака. Фактически, исследования показали, что существуют различные протеомы фосфотирозина опухолей груди и печени. Имеются также данные о гиперфосфорилировании остатков тирозина в опухолях груди, но не в нормальных тканях. Подобные результаты позволяют предположить, что можно найти в опухолевом фосфопротеоме потенциальные биомаркеры.
. Доступно все больше данных, предполагающих, что в различных опухолях существуют особые фосфопротеины и что профилирование фосфорилирования можно использовать для выявления раковых образований различного происхождения. Кроме того, систематическая каталогизация опухолеспецифических фосфопротеинов у отдельных пациентов может выявить несколько причинных факторов во время формирования рака. Путем сопоставления этих экспериментальных данных с клиническими данными, такими как реакция на лекарство и исход заболевания, можно определить потенциальные маркеры рака для диагностики, прогноза, прогнозирования реакции на лекарство и потенциальных мишеней для лекарств.
Хотя фосфопротеомика значительно расширила знания о количестве и типах фосфопротеинов, а также об их роли в сигнальных сетях, эти методы все еще имеют несколько ограничений. Начнем с того, что методы выделения, такие как антифосфотирозиновые антитела, не делают различий между выделением белков, фосфорилированных тирозином, и белков, связанных с белками, фосфорилированными тирозином. Следовательно, даже несмотря на то, что зависимые от фосфорилирования взаимодействия белок-белок очень важны, важно помнить, что белок, обнаруживаемый этим методом, не обязательно является прямым субстратом какой-либо тирозинкиназы. Только путем переваривания образцов перед иммунопреципитацией можно выделить только фосфопротеины и получить временные профили отдельных сайтов фосфорилирования. Другое ограничение состоит в том, что некоторые релевантные белки, вероятно, будут упущены, поскольку условия экстракции не охватывают все. Возможно, что белки с низкой стехиометрией фосфорилирования, в очень низком количестве или фосфорилированные в качестве мишени для быстрой деградации будут потеряны. Биоинформатический анализ данных фосфорилирования с низкой пропускной способностью вместе с данными фосфопротеомики с высокой пропускной способностью (в основном на основе МС / МС) оценивает, что существующие протоколы с высокой пропускной способностью после нескольких повторений способны улавливать от 70% до 95% всех фосфопротеинов, но только 40 от% до 60% от общего количества сайтов фосфорилирования.