 | |
| Имена | |
|---|---|
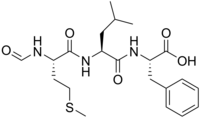
| Название IUPAC ( 2S) -2 - [[(2S) -2 - [[(2S) -2-Формамидо-4-метилсульфанилбутаноил] амино] -4-метилпентаноил] амино] -3-фенилпропановая кислота | |
| Другие названия Хемотактик пептид. F-Met-Leu-Phe. L-фенилаланин, N- (N- (N-формил- L -метионил) - L -лейцил) -. fMLP | |
| Идентификаторы | |
| Номер CAS | |
| 3D-модель (JSmol ) | |
| ChemSpider | |
| IUPHAR / BPS | |
| MeSH | N-Формилметионин + лейцил-фенилаланин |
| PubChem CID | |
| Панель управления CompTox (EPA ) | |
InChI
| |
УЛЫБКА
| |
| Свойства | |
| Химическая формула | C21H31N3O5S |
| Молярная масса | 437,56 г · моль |
| Если не указано иное, данные приведены для материалов в их стандартное состояние (при 25 ° C [77 ° F], 100 кПа). | |
| Ссылки на ink | |
N-Формилметионил -лейцилфенилаланин (fMLF, fMLP или N-формил-мет-лей-phe ) представляет собой N- формилированный трипептид, иногда просто называемый хемотаксический пептид, представляет собой мощный полиморфноядерный лейкоцит (PMN) хемотаксический фактор, а также активатор макрофага.
fMLF является прототипом семейства N-формилированных олигопептидов хемотаксических факторов. Эти олигопептиды, как известно, являются или имитируют действие N-формильных олигопептидов, которые (а) высвобождаются тканевыми бактериями, (б) привлекают и активируют лейкоциты циркулирующей крови путем связывания со специфическими рецепторами, связанными с G-белком на эти клетки, и (c) тем самым направляют воспалительную реакцию на участки бактериальной инвазии. fMLF участвует в механизме врожденного иммунитета для защиты хозяина от патогенов..
fMLF привел к первому открытию лейкоцитарного рецептора для хемотаксического фактора, определив три различных типа рецепторов fMLF, которые имеют дополнительные и / или противодействующие эффекты на воспалительные реакции, а также многие другие активности, и помогли определить механизмы сочетания «стимул-ответ», с помощью которых различные хемотаксические факторы и их рецепторы, связанные с G-белком, индуцируют клеточную функцию.
В 1887 г. Эли Мечников заметил, что лейкоциты, выделенные из крови различных животных, привлекались определенными бактериями. Вскоре было предложено, что это притяжение связано с растворимыми элементами, выделяемыми бактериями (см. Харрис для обзора этой области до 1953 г.). Питер Уорд, Элмер Беккер, Генри Шоуэлл и его коллеги показали, что эти элементы были созданы различными растущими грамположительными бактериями и грамотрицательными бактериями и имели низкую молекулярную массу., т.е. ниже 3600 дальтон (единица) с. Дальнейшие исследования, проведенные Шиффманном и коллегами, показали, что культуры растущих Escherichia coli высвобождают олигопептиды размером от 150 до 1500 дальтон, которые, по-видимому, имеют группу свободной карбоновой кислоты, но не свободный амин. group.
Учитывая эти подсказки и знания о том, что бактерии транскрибируют (см. Транскрипция (генетика) ) белки, начиная с N-формилметионина, тогда как эукариотические клетки в основном инициируют белок синтез с неформилированным метионином, Шиффманн, Коркоран и Валь теоретизировали, а затем показали, что N-формилметионин и ряд N-формилметионил дипептидов и трипептидов стимулируют хемотаксис нейтрофилов, выделенных из перитонеального экссудата кролика. а также макрофагов, выделенных из перитонеального экссудата морских свинок. В дальнейших исследованиях различных N-формилированных олигопептидов, fMLF оказался наиболее эффективным в стимуляции хемотаксиса нейтрофилов кроликов. Затем было обнаружено, что fMLF и выборка других, менее эффективных, N-формилолигопептидов стимулируют широкий спектр функций нейтрофилов кролика, такие как: временная аутоагрегация этих клеток в суспензии и столь же кратковременное падение циркулирующих нейтрофилов при введении кролику вены (эти реакции являются результатом увеличения адгезии нейтрофилов друг к другу и / или эндотелию сосудов); высвобождение (см. дегрануляция ) внутриклеточных ферментов, связанных с гранулами, и других антимикробных цитотоксических молекул; и производство и высвобождение цитотоксических активных форм кислорода, таких как супероксид и пероксид водорода. Все эти ответы являются частью врожденной иммунной системы начальной линии защиты от бактериальных вторжений.
Последующие исследования показали, что гены митохондрий и органелл хлоропластов клеток эукариот, включая клетки человека, которые, в отличие от ядерных генов, кодируют белки N-формилметионина, высвобождают N-формилметионилсодержащие пептиды с хемотаксической активностью, которые точно имитируют хемотаксис fMLF. Эти формилированные пептиды, полученные из органелл, являются настоящими аналогами fMLF, которые действуют через рецепторы fMLF, рекрутируя циркулирующие лейкоциты крови и тем самым инициируя воспалительные реакции в местах повреждения клеток и разрушение тканей, не вызванное бактериями. Было обнаружено, что fMLF и другие N-формилированные олигопептиды проявляют аналогичную активность в нейтрофилах человека. Высокая степень структурной специфичности широкого ряда формилированных пептидов в стимулировании этих нейтрофильных ответов, специфическое связывание N-формилированных олигопептидов с нейтрофилами со сродством, которое соответствует их стимулирующей активности, способность t-карбобензоксифенилаланилметионина связываться с но не стимулируют нейтрофилы и тем самым блокируют связывание нейтрофилов и стимулирующую активность N-формилированных олигопептидов, а также способность формилированных олигопептидов десенсибилизировать (т.е. делать невосприимчивыми) функциональные ответы нейтрофилов на самих себя, но не обладают способностью снижать чувствительность к Ряд других хемотаксических стимулов предоставил убедительные доказательства того, что формилированные пептиды действуют на клетки через общую специализированную рецепторную систему, которая отличается от рецепторов других хемотаксических факторов.
Вышеупомянутые исследования приводят к возможному клонированию человеческого рецептора формилпептида 1, рецептора, связанного с G-белком., который связывает fMLF и другие формилированные олигопептиды, опосредуя их стимулирующее действие на нейтрофилы человека и кролика. Впоследствии рецептор формилпептида 2 и рецептор формилпептида 3 также были клонированы на основании сходства их аминокислотной последовательности с аминокислотной последовательностью рецептора формилпептида 1. Рецепторы 2 и 3 формилпептида имеют очень разные способности связывать и отвечать на формилированные олигопептиды, включая fMLF, по сравнению с рецептором формилпептида 1 и по сравнению друг с другом, и имеют очень разные функции, чем у рецептора формилпептида 1.