реакция Эльбса - это органическая реакция, описывающая пиролиз орто метил замещенный бензофенон на конденсированный полиароматический. Реакция названа в честь ее изобретателя, немецкого химика Карла Эльбса, также ответственного за окисление Эльбса. Реакция была опубликована в 1884 году. Однако Эльбс неправильно интерпретировал продукт реакции из-за отсутствия знаний о структуре нафталина.
Реакция Эльбса позволяет синтезировать конденсированные ароматические системы. Как уже продемонстрировал Эльбс в 1884 году, можно получить антрацен посредством дегидратации. Также возможны более крупные ароматические системы, такие как пентацен. Эта реакция не протекает в одну стадию, но сначала приводит к дигидропентацену, который дегидрируется на второй стадии с медью в качестве катализатора.
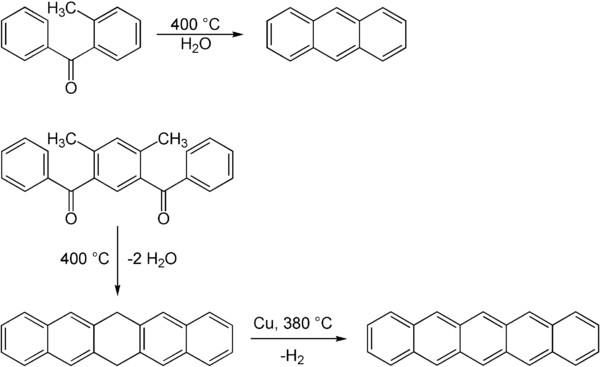
Соединения ацила, необходимые для этой реакции может быть получен посредством ацилирования Фриделя-Крафтса с помощью хлорида алюминия.
Реакция Эльбса иногда сопровождается удалением заместителей и может не подходить для замещенных полиароматических соединений.
Было предложено по крайней мере три вероятных механизма реакции Эльбса. Первый механизм, предложенный Физером, начинается с индуцированной нагреванием циклизации бензофенона с последующим [1,3] -гидридным сдвигом с получением соединение. Затем в результате реакции дегидратации получают полиароматическое соединение.

В качестве альтернативы, во втором механизме, предложенном Куком, метилированное ароматическое соединение сначала подвергается таутомеризации с последующей электроциклической реакцией с получением того же промежуточного продукта, который затем аналогичным образом претерпевает [1,3] -гидридный сдвиг и дегидратация.
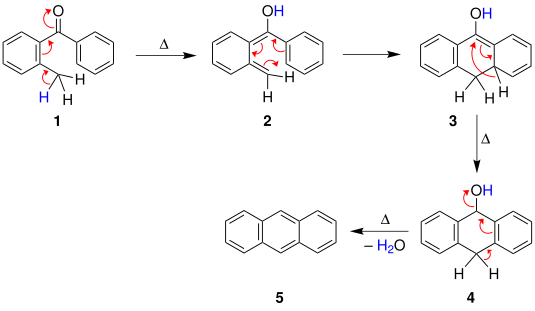
Также был предложен третий механизм, включающий образование пиролитических радикалов.
Также можно синтезировать гетероциклические соединения с помощью реакции Эльбса. В 1956 году была опубликована реакция Эльбса для производного тиофена. Ожидаемый линейный продукт не был получен из-за изменения механизма реакции после образования первого промежуточного соединения, которое вызвало несколько стадий реакции свободных радикалов.
