Сульфиды фосфора представляют собой семейство неорганических соединений, содержащих только фосфор и сера. Эти соединения имеют формулу P 4Sxс x ≤ 10. Два из них имеют коммерческое значение: пентасульфид фосфора (P4S10), который производится в килотонном масштабе для производства других сероорганических соединений, и фосфор. сесквисульфид (P4S3), используемый при производстве «спичек с нанесением ударов в любом месте».
Помимо P 4S3и P 4S10, существует несколько других сульфидов фосфора. Шесть из этих сульфидов фосфора существуют в виде изомеров : P 4S4, P 4S5, P 4S6, P 4S7, P 4S8и P 4S9. Эти изомеры отличаются префиксом греческих букв. Префикс основан на порядке открытия изомеров, а не на их структуре. Все известные молекулярные сульфиды фосфора содержат тетраэдрический массив из четырех атомов фосфора. P 4S2также известен, но он нестабилен при температуре выше -30 ° C.
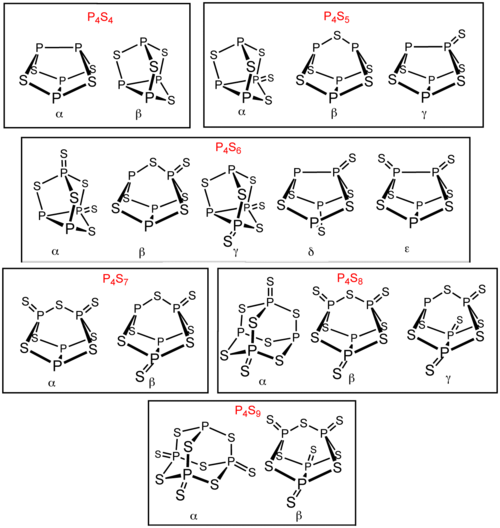 Сульфиды фосфора, существующие в изомерных формах
Сульфиды фосфора, существующие в изомерных формах Основным методом получения этих соединений является термолиз смеси фосфора и серы. Распределение продуктов можно анализировать с помощью P ЯМР-спектроскопии. Более селективный синтез влечет за собой (i) обессеривание, например с использованием трифенилфосфина и, дополнительно, (ii) сульфидирования с использованием трифениларсин сульфида.
Сесквисульфид фосфора получают обработкой красного фосфора серой при температуре выше 450 К с последующей осторожной перекристаллизация с сероуглеродом и бензолом. Альтернативный метод включает контролируемое слияние белого фосфора с серой в инертном негорючем растворителе.
α- и β- формы P 4S4могут быть получены обработкой соответствующих изомеров P 4S3I2с помощью ((CH 3)3Sn) 2S:
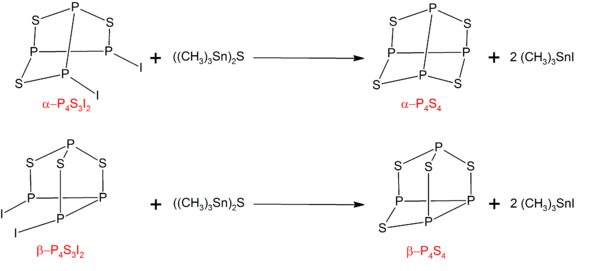
P4S3I2может быть синтезирован взаимодействием стехиометрических количеств фосфора, серы и йода.
P4S5может быть получен обработкой стехиометрических количеств P 4S3серой в растворе сероуглерода, в присутствии света и каталитического количества йода. Соответствующее распределение продуктов затем анализируют с помощью P ЯМР-спектроскопии.
В частности, α-P 4S5может быть легко получен с помощью фотохимическая реакция P 4S10с красным фосфором. Обратите внимание, что P 4S5нестабилен при нагревании, стремясь к непропорционально до P 4S3и P 4S7до достижения его точка плавления.
P4S6может быть получена путем отделения атома серы от P 4S7с использованием трифенилфосфина :
Обработка α-P 4S5Ph 3 AsS в CS 2 также дает α -P 4S6. Два новых полиморфа δ-P 4S6и ε-P 4S6могут быть получены путем обработки α-P 4S4Ph 3 SbS в CS 2.
P4S7наиболее удобно получить прямым объединением соответствующих элементов, и является одним из наиболее легко очищаемых бинарных сульфидов фосфора.
β-P 4S8может быть получен обработкой α-P 4S7Ph 3 AsS в CS 2, который дает смесь α-P 4S7и β-P 4S8.
P4S9, может быть получен двумя способами. Один метод включает нагревание P 4S3в избытке серы. Другой метод включает нагревание P 4S7и P 4S10в мольном соотношении 1: 2, где P 4S9образуется обратимо:
P4S10 является одним из наиболее устойчивые сульфиды фосфора. Его легче всего получить, нагревая белый фосфор с серой выше 570 К.