 | |
| Клинические данные | |
|---|---|
| Код УВД | |
| Идентификаторы | |
Название ИЮПАК
| |
| Количество CAS | |
| PubChem CID | |
| ChemSpider | |
| UNII | |
| Панель управления CompTox ( EPA) | |
| ECHA InfoCard | 100.024.613 |
| Химические и физические данные | |
| Формула | С 23 Н 30 О 3 |
| Молярная масса | 354,490 г моль -1 |
| 3D модель ( JSmol ) | |
Улыбки
| |
ИнЧИ
| |
| | |
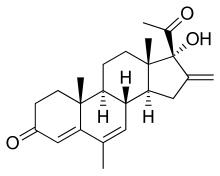
Меленгестрол ( INN, BAN ) - стероидный прогестин из группы 17α-гидроксипрогестерона и противоопухолевый препарат, который никогда не продавался. Ацилируют производный, меленгестрол ацетат, используют в качестве промотора роста у животных.
Хотя меленгестрол иногда используется как синоним ацетата меленгестрола, обычно речь идет о ацетате меленгестрола, а не о меленгестроле.
6-Метил-16-дегидропрегненолонацетат ( 5 ) является ключевым промежуточным продуктом для получения как ацетата меленгестерина, так и медрогестона. Петров и его сотрудники разработали несколько интересных схем, которые восходят к диосгенину в качестве отправной точки. Эти схемы выполняют необходимые модификации в кольцах A и B с сохранением боковой цепи сапогенина. По сути, этот подход использует эту боковую цепь в качестве защитной группы для будущей функции 16-дегидро-20-кетона. По одному из этих способов диосгенин сначала превращается в 3-толуолсульфонат ( 1 ). Сольволиз этого производного гомоаллилового спирта дает 3,5-циклостероид ( 2 ) через ион циклопропилкарбинила ( ион карбения ) (не показан). (Эта общая реакция, вероятно, впервые была обнаружена в стероидах и носила название « i -стероидная перегруппировка».) Окисление продукта с помощью PCC дает кетон. Реакция этого с метилмагниемиодидом дает два изомерных карбинола с преобладающим α-изомером ( 3 ). Сольволиз в присутствии нуклеофила, такого как уксусная кислота, обращает циклопропилкарбинильное превращение с образованием гомоаллилового ацетата. Удаление боковой цепи сапогенина приводит к желаемому продукту ( 5 ).
 Синтез меленгестерина:
Синтез меленгестерина: Было обнаружено, что замена в позиции 16 приводит к дальнейшему усилению прогестагенной активности. Реакция с диазометаном по сопряженной двойной связи у 16 дает сначала пиразол ( 6 ). Этот гетероцикл дает 16 метильный енон на пиролизе ( 7 ). Селективное эпоксидирование сопряженной двойной связи с 16,17α-эпоксидом по сравнению с эпоксидом 5,6 достигается окислением щелочной перекисью водорода ( 8 ). Раскрытие этого тетразамещенного оксиранового кольца в кислоте протекает с потерей протона из β-положения (16-метил) ( 9 ) с получением желаемой функциональной группы 16-метилен-17α-гидрокси-20-кетона в D-кольце ( 10 ). Продукт омыляется и затем подвергается окислению Оппенауэра, которое затем дегидрируется до 4,6-диена с помощью хлоранила ( 11 ). Ацетилирование в форсирующих условиях завершает синтез ацетата меленгестерина.