 Спиновые изомеры молекулярного водорода
Спиновые изомеры молекулярного водорода Молекулярный водород встречается в две изомерные формы, одна с двумя протонными ядерными спинами, выровненными параллельно (ортоводород), другая с двумя своими протонными спинами, выровненными антипараллельно (параводород). Эти две формы часто называют спиновыми изомерами.
Параводород находится в более низком энергетическом состоянии, чем ортоводород. При комнатной температуре и тепловом равновесии тепловое возбуждение заставляет водород состоять приблизительно из 75% ортоводорода и 25% параводорода. Когда водород сжижается при низкой температуре, происходит медленный самопроизвольный переход к преимущественно пара-соотношению, при этом выделяемая энергия имеет значение для хранения. По существу чистая форма параводорода может быть получена при очень низких температурах, но невозможно получить образец, содержащий более 75% ортоводорода, путем нагревания.
Смесь или смесь орто- и параводорода в соотношении 50:50 может быть получена в лаборатории путем пропускания ее над катализатором на основе оксида железа (III) при температуре жидкого азота (77 K) или хранением водорода при 77 К в течение 2–3 часов в присутствии активированного угля. В отсутствие катализатора параводороду в газовой фазе требуются дни для релаксации до нормального водорода при комнатной температуре, в то время как в органических растворителях для этого требуются часы.
Каждая молекула водорода (H2) состоит из двух атомов водорода, связанных ковалентной связью. Если пренебречь небольшой долей дейтерия и трития, которые могут присутствовать, каждый атом водорода состоит из одного протона и одного электрон. Каждый протон имеет связанный магнитный момент, который связан со спином протона 1/2. В молекуле H 2 спины двух ядер водорода (протонов) соединяются с образованием триплетного состояния, известного как ортоводород, и синглета . состояние, известное как параводород .
Состояние триплетного ортоводорода имеет полный ядерный спин I = 1, так что компонент вдоль определенной оси может иметь три значения M I = 1, 0, или -1. Соответствующие волновые функции ядерного спина: 



Поскольку протоны имеют спин 1/2, они фермионы, и пермутационная антисимметрия полной волновой функции H 2 налагает ограничения на возможные вращательные состояния двух форм H 2. Ортоводород с симметричными функциями ядерного спина может иметь только вращательные волновые функции, антисимметричные по отношению к перестановке двух протонов, соответствующие нечетным значениям вращательного квантового числа J; и наоборот, параводород с антисимметричной функцией ядерного спина может иметь только вращательные волновые функции, симметричные относительно перестановки двух протонов, соответствующие даже J.
Пара-форма, нижний уровень которой J = 0, больше стабильна на 1,06 кДж / моль, чем орто-форма, нижний уровень которой составляет J = 1. Отношение между количеством орто- и пара-молекул составляет примерно 3: 1 при стандартной температуре, где заселяются многие уровни энергии вращения, что благоприятствует орто-форма в результате воздействия тепловой энергии. Однако при низких температурах в значительной степени заселен только уровень J = 0, так что параформа доминирует при низких температурах (около 99,8% при 20 K). теплота испарения составляет всего 0,904 кДж / моль. В результате орто-жидкий водород, уравновешенный параформой, выделяет достаточно энергии, чтобы вызвать значительные потери при кипении.
Применяя приближение жесткого ротора, энергии и вырождения вращательных состояний определяются следующим образом:
 .
.Вращательная функция распределения условно записывается как:
 .
.Однако, пока два спиновые изомеры не находятся в равновесии, более полезно записать отдельные статистические суммы для каждого:

Коэффициент 3 в статистической сумме для ортоводорода учитывает вырождение спина, связанное с состоянием спина +1 ; когда возможно равновесие между спиновыми изомерами, то общая статистическая сумма, учитывающая эту разницу вырождений, может быть записана как:

Молярная энергия вращения и теплоемкость выводятся для любого из этих случаев из:

Графики, показанные здесь, являются молярным вращением энергии и теплоемкости для орто- и параводорода, а также «нормальных» орто / пара (3: 1) и равновесных смесей:
 Молярные энергии вращения
Молярные энергии вращения 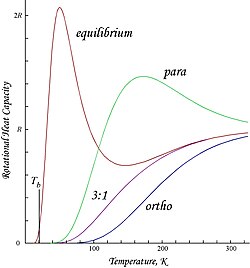 Молярные теплоемкости; показан только вклад вращения и вращения. Общее значение на 1,5R выше из-за поступательных степеней свободы (степени вращения были включены в само приближение жесткого ротора).
Молярные теплоемкости; показан только вклад вращения и вращения. Общее значение на 1,5R выше из-за поступательных степеней свободы (степени вращения были включены в само приближение жесткого ротора). Из-за наложенного антисимметрией ограничения на возможные состояния вращения ортоводород имеет остаточную энергию вращения при низкой температуре, при которой почти все молекулы находятся в состоянии J = 1 (молекулы в симметричном спин-триплетном состоянии не могут упасть в самое низкое, симметричное вращательное состояние) и обладают ядерной спиновой энтропией из-за трехкратного вырождения триплетного состояния. Остаточная энергия важна, потому что уровни энергии вращения относительно широко разнесены в H 2 ; зазор между первыми двумя уровнями, выраженный в единицах температуры, в два раза больше характерной температуры вращения для H 2:
 .
.Это точка пересечения T = 0, наблюдаемая в молярной энергии ортоводорода. Поскольку "нормальный" водород при комнатной температуре представляет собой орто: пара смесь 3: 1, его молярная остаточная энергия вращения при низкой температуре составляет (3/4) × 2Rθ rot ≈ 1091 Дж / моль, что несколько меньше больше, чем энтальпия испарения нормального водорода, 904 Дж / моль при температуре кипения, T b ≈ 20,369 К. В частности, температуры кипения параводорода и нормального (3: 1) водород почти равны; для параводорода ∆H vap ≈ 898 Дж / моль при T b ≈ 20,277 K, из чего следует, что почти вся остаточная энергия вращения ортоводорода сохраняется в жидком состоянии.
Однако ортоводород термодинамически нестабилен при низких температурах и самопроизвольно превращается в параводород. В этом процессе отсутствует какой-либо естественный режим излучения девозбуждения, поэтому он протекает медленно в отсутствие катализатора, который может способствовать взаимному преобразованию синглетного и триплетного спиновых состояний. При комнатной температуре водород содержит 75% ортоводорода, пропорцию, которую сохраняет процесс сжижения, если его проводят в отсутствие катализатора, такого как оксид железа, активированный уголь, платинированный асбест, редкоземельные металлы, соединения урана, оксид хрома или некоторые соединения никеля для ускорения превращения жидкого водорода в параводород. В качестве альтернативы можно использовать дополнительное холодильное оборудование для медленного поглощения тепла, которое фракция ортоводорода будет (более медленно) выделять, когда она самопроизвольно превращается в параводород. Если ортоводород не удаляется из быстро сжиженного водорода без катализатора, тепло, выделяющееся при его распаде, может испарить до 50% исходной жидкости.
Необычная теплоемкость водорода была обнаружена в 1912 году Арнольдом Ойкеном. Две формы молекулярного водорода были впервые предложены Вернером Гейзенбергом и Фридрихом Хундом в 1927 году. Принимая во внимание эту теоретическую основу, чистый параводород был впервые синтезирован Полом Хартеком и Карл Фридрих Бонхёффер в 1929 году. Когда Гейзенбергу в 1932 году была присуждена Нобелевская премия по физике за создание квантовой механики, это открытие «аллотропных форм водорода» было выделено как наиболее примечательное ее применение. Современное выделение чистого параводорода с тех пор было достигнуто с помощью быстрого осаждения в вакууме образцов твердого параводорода толщиной в миллиметры (p – H 2), которые отличаются превосходными оптическими качествами.
Когда во время реакций гидрирования используется избыток параводорода (вместо нормальной смеси ортоводорода с параводородом 3: 1), полученный продукт показывает гиперполяризованный сигналов в протонном ЯМР спектрах, эффект, называемый PHIP (параводородная поляризация) или, что эквивалентно, PASADENA (параводород и синтез позволяют значительно улучшить ядерное выравнивание; назван в честь первого признания эффекта Бауэрсом и Вайтекампом Caltech ), явление, которое использовалось для изучения механизма реакций гидрирования.
Усиление сигнала путем обратимого обмена (SABER) - это метод гиперполяризации образцов без химического изменения их. По сравнению с ортоводородом или органическими молекулами, гораздо большая часть ядер водорода в параводороде совмещена с приложенным магнитным полем. В SABRE металлический центр обратимо связывается как с исследуемой молекулой, так и с молекулой параводорода, облегчая целевую молекулу улавливать поляризацию параводорода. Этот метод можно улучшить и использовать для широкого диапазона органических молекул, используя промежуточную «ретрансляционную» молекулу, такую как аммиак. Аммиак эффективно связывается с металлическим центром и улавливает поляризацию параводорода. Затем аммиак переносит другие молекулы, которые не связываются также с металлическим катализатором. Этот усиленный сигнал ЯМР позволяет быстро анализировать очень небольшие количества материала.
Двухатомный дейтерий (D2) имеет изомеры ядерного спина, такие как двухатомный водород, но с разными популяциями этих двух форм, поскольку ядро дейтерия (дейтрон) является бозон со спином ядра, равным единице. Существует шесть возможных волновых функций ядерных спинов, которые являются орто- или симметричными по отношению к обмену двух ядер, и три являются пара- или антисимметричными. Орто-состояния соответствуют четным вращательным уровням с симметричными вращательными функциями, так что полная волновая функция является симметричной, как требуется для обмена двумя бозонами, а пара-состояния соответствуют нечетным вращательным уровням. Основное состояние (J = 0) при низкой температуре является орто, а при стандартной температуре соотношение орто: пара составляет 2: 1.
Другие молекулы и функциональные группы, содержащие два атома водорода, такие как вода и метилен, также имеют орто- и пара-формы (например, ортовода и паравода), но это не имеет большого значения для их тепловых свойств. Их орто-пара-отношения отличаются от соотношения дигидрогена.
Молекулярный кислород (O. 2) также существует в трех триплетных состояниях с более низкой энергией и в одном синглетном состоянии, как парамагнитный триплетный кислород в основном состоянии и активированный высокореактивный диамагнетик синглетный кислород. Эти состояния возникают из-за спинов их неспаренных электронов, а не их протонов или ядер.