 Структура аниона
Структура аниона В химии ортосиликат представляет собой анион SiO. 4или любую из его солей и сложных эфиров. Это один из силикатных анионов. Иногда его называют тетроксидом кремния анионом или группой.
ортосиликатными солями, такими как ортосиликат натрия, они стабильны и широко встречаются в природе как силикатные минералы, являющийся определяющим признаком несосиликатов. Оливин, ортосиликат магния или железа (II), является наиболее распространенным минералом в верхней мантии.
ортосиликатный анион представляет собой сильное основание, сопряженное основание чрезвычайно слабой ортокремниевой кислоты H. 4SiO. 4(pK a2 = 13,2 ат. 25 ° С). Это равновесие трудно исследовать, поскольку кислота имеет тенденцию разлагаться на гидратированный кремнезем конденсат.
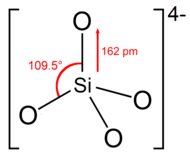
Ортосиликатный ион или группа имеет тетраэдрическую форму с одним атомом кремния, окруженным четырьмя атомами кислорода.
В анионе каждый кислород несет единичный отрицательный заряд. Связь Si – O имеет длину 162 пм.
В органических соединениях, таких как тетраметилортосиликат, каждый кислород формально нейтрален и связан с остальной частью молекулы одним ковалентным Связка.
ортосиликат бария, легированный европием (Ba 2 SiO 4), представляет собой обычный люминофор, используемый в зеленом свете -излучающие диоды (светодиоды). Люминофор для синих светодиодов может быть изготовлен из ортосиликата бария, легированного стронцием. Ортосиликат бария - основная причина катодного отравления в электронных лампах.
Хотя ортосиликатный ион очень важен в неорганической химии и геохимии, он редко встречается в органической химии.. Однако в органическом синтезе используются два силикатных соединения: тетраэтилортосиликат или TEOS используется для связывания полимеров и особенно важен при производстве аэрогелей. Тетраметилортосиликат или TMOS используется в качестве альтернативы TEOS, а также имеет ряд других применений в качестве реагента. TEOS предпочтительнее TMOS, поскольку TMOS разлагается с образованием высоких концентраций токсичного метанола. Вдыхание TMOS может привести к токсическому накоплению кремнезема в легких.