 | |
| Имена | |
|---|---|
| Название IUPAC Хром (III) сульфат | |
| Другие названия Основной сульфат хрома, сульфат хрома | |
| Идентификаторы | |
| Номер CAS |
|
| 3D модель (JSmol ) | |
| ChEBI | |
| ChemSpider | |
| ECHA InfoCard | 100.030.217 |
| Номер EC |
|
| PubChem CID | |
| UNII | |
| Номер ООН | 2240 3077 |
| CompTox Dashboard (EPA ) | |
InChI
| |
УЛЫБАЕТСЯ
| |
| Свойства | |
| Химическая формула | Cr2(SO 4)3• 12H 2O |
| Молярная масса | 392,16 г / моль. 608,363 г / моль (додекагидрат). 716,45 г / моль (октадекагидрат) |
| Внешний вид | красновато-коричневые кристаллы (безводные), пурпурные кристаллы (гидратированные) |
| Плотность | 3,10 г / см (безводные). 1,86 г / см (пентадекагидрат). 1,709 г / см (октадекагидрат) |
| Точка плавления | 90 ° C |
| Точка кипения | >700 ° C (разлагается до хромовой кислоты ) |
| Растворимость в воде | нерастворимый (безводный). растворимый (гидратированный) |
| Растворимый | растворимый в спирте. практически нерастворимый в кислоте |
| Магнитная восприимчивость (χ) | + 11,800 · 10 см / моль |
| Опасности | |
| Паспорт безопасности | MSDS |
| Пиктограммы GHS |     |
| Сигнальное слово GHS | Предупреждение |
| Предупреждения об опасности GHS | H314, H317, H332, H334, H335, H340, H350, H373, H412 |
| Меры предосторожности GHS | P201, P202, P260, P261, P264, P271, P272, P273, P280, P281, P285, P301 + 330 + 331, P302 + 352, P303 + 361 + 353, P304 + 312, P304 + 340, P304 + 341, P305 + 351 + 338, P308 + 313, P310, P312, P314, P321, P333 + 313, P342 + 311 |
| NFPA 704 (огненный алмаз) |  0 1 0 0 1 0 |
| Температура вспышки | Невоспламеняющийся |
| NIOSH (пределы воздействия на здоровье в США): | |
| PEL (Допустимо) | TWA 1 мг / м |
| REL (рекомендуется) | TWA 0,5 мг / м |
| IDLH (непосредственная опасность) | 250 мг / м |
| За исключением случаев, когда иное отмечено, что данные приведены для материалов в их стандартном состоянии (при 25 ° C [77 ° F], 100 кПа). | |
| Ссылки в ink | |
Сульфат хрома (III) обычно относится к неорганическим соединениям с формулой Cr2(SO 4)3x (H 2 O), где x может находиться в диапазоне от 0 до 18. Кроме того, неопределенный, но коммерчески важный Известны также «основные сульфаты хрома». Эти соли обычно представляют собой твердые вещества фиолетового или зеленого цвета, растворимые в воде. Обычно используется в дублении кожи.
Три сульфата хрома (III) хорошо охарактеризованы:
Известен ряд других сульфатов хрома (VI), но они также содержат гидроксидные или оксидные лиганды. Наиболее важным с коммерческой точки зрения является основной сульфат хрома, который считается [Cr 2(H2O)6(OH) 4 ] SO 4 (CAS № 39380-78- 4). Это происходит в результате частичной нейтрализации гексагидратов. Сообщалось о других гидроксидах хрома (III).
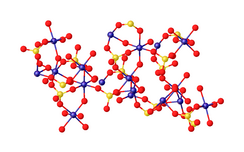 Структура Cr (SO 4) (H 2 O) (OH), показывающая CrO 6 координационная сфера, типичная для многих соединений хрома (III).
Структура Cr (SO 4) (H 2 O) (OH), показывающая CrO 6 координационная сфера, типичная для многих соединений хрома (III). Наиболее полезным источником сульфата хрома (III) являются отходы Cr (III) от окисления хроматом различных органических соединений. Антрохинон и хинон производятся в больших масштабах путем обработки антрацена и фенола хромовой кислотой. Образуется побочный продукт оксида хрома (III), который легко экстрагируется серной кислотой. Выпаривание этих кислых растворов дает описанную выше гидратную соль. Гидратированные соли сульфата хрома также могут быть получены, хотя и неочищенные, путем экстракции различных других соединений хрома, но эти способы экономически невыгодны. Экстракция хромитовой руды серной кислотой в присутствии некоторого количества хромата дает растворы хрома (III) сульфат, загрязненный ионами других металлов. Точно так же растворение хромовых сплавов дает сульфат хрома вместе с сульфатом железа.
Основной сульфат хрома получают из хроматных солей восстановлением диоксидом серы, хотя существуют и другие методы. Формально сокращение можно записать:
Поскольку 33% зарядов аниона обусловлены гидроксильными ионами, основность составляет 33% (но на жаргоне дубильного это известно как пониженное на 33%). Продукты с более высокой основностью, например 42 % или 50% можно получить путем добавления карбоната натрия, они часто используются в сочетании с формиатом натрия. Сульфат натрия часто остается в техническом продукте, поскольку он инертен Что касается процесса дубления. Важно полностью восстановить шестивалентный хром до трехвалентного, поскольку шестивалентный хром с большей вероятностью вызовет проблемы со здоровьем у дубильщиков и потребителей кожи.