| (Морита–) Реакция Бейлиса – Хиллмана | |
|---|---|
| Назван в честь | Кен-ичи Морита. Энтони Б. Бейлис. Мелвилл Э.Д. Хиллман |
| Тип реакции | Реакция связывания |
| Идентификаторы | |
| Портал органической химии | реакция Бейлиса-Хиллмана |
| RSC ID онтологии | RXNO: 0000076 |
Реакция Бейлиса-Хиллмана представляет собой реакцию образования углерод-углеродной связи между α-положением активированного алкена и углеродным электрофилом, таким как альдегид. При использовании нуклеофильного катализатора, такого как третичный амин и фосфин, эта реакция дает продукт с плотной функционализацией (например, функционализированный аллиловый спирт в случае альдегида в качестве электрофила). Он назван в честь Энтони Б. Бэйлиса и Мелвилла Д. Хиллмана, двух химиков, которые разработали эту реакцию во время работы в Celanese. Эта реакция также известна как реакция Морита-Бейлиса-Хиллмана или реакция MBH, поскольку Морита опубликовал более раннюю работу по ней.
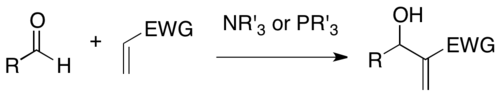
DABCO является одним из наиболее часто используемых катализаторов на основе третичного амина для этой реакции. Кроме того, было обнаружено, что нуклеофильные амины, такие как DMAP и DBU, а также фосфины успешно катализируют это реакция.
Реакция MBH как полезный метод синтеза имеет несколько преимуществ: 1) Это атомарно-экономичное сочетание легко получаемых исходных материалов. 2) Реакция прохирального электрофила генерирует хиральный центр, поэтому возможен асимметричный синтез. 3) Продукты реакции обычно содержат несколько функциональных групп в непосредственной близости, так что возможно множество дальнейших превращений. 4) Он может использовать нуклеофильную органо-каталитическую систему без использования тяжелых металлов в мягких условиях.
Было написано несколько обзоров.
Хоффманн первым предложил механизм реакции MBH. Первая стадия реакции включает 1,4-присоединение каталитического третичного амина к активированному алкену с образованием цвиттерионного аза-енолята. На второй стадии этот енолят присоединяется к альдегиду путем присоединения альдола. Третий этап включает внутримолекулярный протонный сдвиг, который впоследствии генерирует конечный аддукт MBH и высвобождает катализатор посредством отщепления E2 или E1cb на последней стадии. Хилл и Айзекс провели кинетические эксперименты, чтобы исследовать детали механизма. Скорость реакции между акрилонитрилом и ацетальдегидом была первого порядка по концентрации акрилонитрила, ацетальдегида и DABCO. Хилл и Айзекс предположили, что стадия добавления альдола, в которой участвуют все три реагента, является, таким образом, стадией, определяющей скорость. То, что они не наблюдали кинетический изотопный эффект при использовании α-дейтерированного акрилонитрила, также подтверждает это утверждение.

Однако это первоначальное механистическое предложение подверглось критике по нескольким причинам. Скорость реакции MBH увеличивалась из-за накопления продукта (автокаталитический эффект), что не могло быть объяснено с помощью механизма. Также не ожидалось образование значительного количества «необычного» побочного продукта диоксанона в реакции MBH арилальдегидов с акрилатами.
McQuade et al. и Aggarwal et al. переоценили механизм MBH, используя как кинетические, так и теоретические исследования, сосредоточив внимание на стадии переноса протона. Согласно Маккуэду, реакция MBH между метилакрилатом и п-нитробензальдегидом является вторым порядком по отношению к альдегиду и показывает значительный кинетический изотопный эффект в α-положении акрилата (5,2 в ДМСО). Независимо от растворителей было обнаружено, что КИЭ превышает 2, что указывает на значимость отрыва протонов на этапе определения скорости. Основываясь на этих новых данных, Маккуэйд предложил новый механизм, предполагающий, что этап переноса протона - это RDS. Первую и вторую стадии не изменяют, но после добавления первого альдола происходит второе добавление альдегида с образованием алкоксида полуацеталя. Затем на стадии определяющего скорость переноса протона через шестичленное переходное состояние высвобождается аддукт A, который дополнительно реагирует с образованием продукта MBH B или побочного продукта диоксанона C . Этот механизм объясняет образование побочного продукта диоксанона.
Аггарвал сосредоточил внимание на автокаталитическом эффекте и заметил, что каталитические количества продукта MBH или метанола устраняют этот эффект. Таким образом, он предположил, что на ранней стадии реакции работает механизм, не катализируемый спиртом, что эквивалентно предложению МакКуэда, тогда как после 20% -ной конверсии механизм, катализируемый спиртом, доминирует. На этой более поздней стадии спирт R'OH способствует стадии переноса протона, определяющей скорость, через шестичленное переходное состояние. Аггарвал и Харви смоделировали эти два пути, используя расчеты теории функционала плотности, и показали, что рассчитанный энергетический профиль хорошо согласуется с экспериментальным кинетическим изотопным эффектом и наблюдаемой скоростью реакции. Также они показали, что общий энтальпический барьер пути, катализируемого спиртом, немного меньше, чем у пути, катализируемого не спиртом, обосновывая это тем, что по мере увеличения концентрации спирта (продукта MBH), путь, катализируемый спиртом, начинает доминировать, демонстрируя автокатализ.

Хотя исследованиям Маккуэда и Аггарвала в последнее время уделяется много внимания, есть ряд проблем, которые еще не решены. Во-первых, предложение Маккуэда о роли промежуточного звена A явно не доказано. Поскольку A может быть образован простым добавлением B к альдегиду, образование A и C могло происходить за пределами MBH. механизм. Маккуэйд утверждает, что на этапе определения скорости участвуют две молекулы альдегида, поскольку скорость реакции является вторым порядком по альдегиду, но не объясняет, почему Хилл и Исаак наблюдали первый порядок для своих субстратов. В самом деле, огромное разнообразие субстратов для реакции MBH является ограничением для исследования общего механизма реакции MBH единым образом. Кроме того, Аггарвал ранее предположил, что RDS реакции изменяется от переноса протона к добавлению альдола в ходе реакции, основываясь на том факте, что первичный кинетический изотопный эффект исчезает после 20% конверсии, но последующие вычислительные исследования пришли к выводу, что стадия переноса протона все еще имеет самый высокий барьер на поздней стадии реакции. Несоответствие между кинетическими и расчетными результатами означает, что механистические аспекты реакции МБГ все еще недостаточно изучены.
Недавно Коэльо и Эберлин и др. использовали данные ESI-MS для получения экспериментальных данных, подтверждающих дуалистическую природу стадии переноса протона в реакции, тем самым предоставив первое структурное свидетельство механистических предположений Маккуэда и Аггарвала для этой стадии реакции RDS.
Тем не менее, модель Aggarwal пролила свет на асимметричный катализ реакции MBH. Было высказано предположение, что все четыре диастереомера промежуточного алкоксида образуются в реакции, но только один имеет донор водородной связи, подходящий для обеспечения быстрого переноса протона, в то время как другие диастереомеры превращаются в исходные материалы. Эти механистические исследования привлекли внимание к протонодонорной способности (кислота Бренстеда) катализатора. Если бы кислоту Бренстеда или основание Льюиса можно было бы надлежащим образом расположить на хиральной молекуле, основание Льюиса реагировало бы с субстратом (добавление Михаэля), в то время как кислота в асимметричной среде позволила бы перенос хирального протона. Кислота Бренстеда остается связанной водородными связями с полученным енолятом на стадии присоединения енолята к альдегиду и, наконец, обеспечивает эффективный перенос протона на определяющей скорость стадии отрыва протона. Действие сокатализаторов Бренстеда, которые часто используются в реакции MBH, не ограничивается ролью на стадии переноса протона. Он скорее способствует добавлению конъюгата путем связывания с цвиттерионным енолятом и стабилизации этих промежуточных продуктов.

Поскольку двумя компонентами реакции MBH являются активированный алкен и электрофил, может быть образовано огромное количество комбинаций партнеров реакции. В частности, реакция аза-Бейлиса – Хиллмана является важным вариантом реакции MBH с использованием иминов в качестве электрофилов. Хотя в большинстве случаев в качестве электрофилов используются альдегиды, кетоны или имины, было зарегистрировано несколько отчетов об использовании аллилгалогенидов, алкилгалогенидов и эпоксидов.
Аддукты Бейлиса-Хиллмана и их производные были зарегистрированы. широко используется для создания гетероциклов и других циклических структур.
Использование аллена вместо простого алкена в качестве предшественника дает промежуточное соединение, которое может реагировать при гамма-углерод, а не альфа.
Поскольку реакционные субстраты сильно различаются, часто бывает сложно разработать условия реакции, подходящие для определенное сочетание субстратов. Например, β-замещенные активированные олефины, винилсульфоны и винилсульфоксиды обладают низкой реакционной способностью, замедляя или предотвращая реакцию. Конкурирующие реакции функциональных возможностей субстрата также проблематичны. Акролеины склонны к олигомеризации, а алленоаты легко вступают в реакции циклоприсоединения. Чрезвычайно трудно разработать подходящие условия для использования галогенидов и эпоксидов в качестве электрофилов.
Несмотря на широкий масштаб, атомную экономию и универсальность реакции, медленная скорость реакции Бейлиса-Хиллмана (время реакции две недели или даже больше не является редкостью, даже с 25-100 мол.% Катализатора) для затрудненных алифатических альдегидов и бензальдегидов, богатых электронами, часто ограничивает синтетическую полезность процесса. Например, в случае стерически затрудненного трет-бутилакрилата реакция с бензальдегидом с DABCO в качестве катализатора в отсутствие растворителя требует 4 недель для получения умеренных уровней превращения в желаемый продукт. В присутствии апротонных растворителей скорость реакции еще ниже, хотя протонные добавки (например, спирты и карбоновые кислоты) могут ускорить реакцию. Кетоны обычно недостаточно реакционноспособны, чтобы принимать участие в реакции синтетически полезным способом в обычных условиях. Однако из-за крайне отрицательного объема активации медленные реакции Бейлиса-Хиллмана, в том числе с использованием кетонов в качестве субстратов, могут быть реализованы путем проведения реакции под высоким давлением (до 20 кбар).

Высокая реакционная способность активированного алкена тоже может быть проблемой. Реакция MBH арилвинилкетона с альдегидом не является простой, поскольку реакционноспособный арилвинилкетон легко присоединяется сначала к другой молекуле арилвинилкетона посредством присоединения Михаэля, а затем аддукт присоединяется к альдегиду с образованием двойного аддукта MBH. 191>Общее решение асимметричной реакции MBH различных субстратов также все еще отсутствует. В целом реакция MBH еще не достигла зрелой стадии, и есть еще много возможностей для разработки мощных и общих каталитических систем.
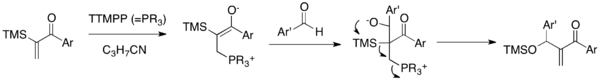
Реакция Sila-MBH представляет собой вариант MBH, который связывает α-силилированные виниларилкетоны с альдегидами в присутствии каталитического TTMPP (Схема 5). Цвиттерионный енолят, полученный при добавлении нуклеофильного катализатора к енону, будет подвергаться присоединению к карбонильной группе альдегида с образованием алкоксида. Этот алкоксид подвергается последующей 1,3- перегруппировке Брука и каскаду отщепления с получением силоксиметилененона и высвобождением катализатора. Эта реакция позволяет синтезировать силоксиметиленариленоны, класс которых был недоступен с помощью традиционной реакции MBH. Важно отметить, что эта реакция решает проблему двойного присоединения MBH арилвинилкетонов.
Реакция Раухута-Каррие представляет собой реакцию активированного алкена и акцептора Михаэля, а не альдегида или имина. Ее также называют винилогичной реакцией MBH. Поскольку в реакции Раухута-Карриера часто соединяются два активированных алкена, возникают проблемы с селективностью. Внутримолекулярная реакция Раухута-Курье была использована благодаря улучшенной реакционной способности и селективности. Например, циклизация α, β-ненасыщенных альдегидов по Рауху-Карриеру может быть проведена в присутствии производного пролина и уксусной кислоты, давая энантиообогащенные продукты.

Многокомпонентная реакция Стратегия привлекательна своей атомарной экономичностью. Реакция MBH может использоваться для трехкомпонентного связывания альдегидов, аминов и активированных алкенов с получением аддуктов аза-MBH. Например, реакции арилальдегидов, дифенилфосфинамида и метилвинилкетона в присутствии TiCl 4, трифенилфосфина и триэтиламина дают соответствующие аддукты аза-MBH.

Кроме того, активированные ацетилены могут быть добавленным к электрофилам после добавления Майкла . Триметилсилилиодид в качестве донора Михаэля может выполнять трехкомпонентную реакцию, в то время как тандемная циклизация также возможна через атаку Михаэля фрагмента в электрофиле MBH.

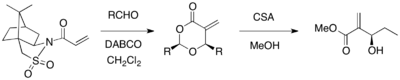
Сультам Оппольцера можно использовать в качестве хирального вспомогательного вещества для асимметричной реакции MBH. Когда акрилат, замещенный сультамом Оппольцера, реагировал с различными альдегидами в присутствии катализатора DABCO, были получены оптически чистые 1,3-диоксан-4-оны с расщеплением вспомогательного вещества (выход 67-98%,>99% ее). Циклические продукты могут быть превращены в желаемые продукты MBH с использованием CSA и метанола.
Родственный гидразидный вспомогательный компонент также может быть использован для аналогичной реакции MBH, катализируемой DABCO. Хиральный акрилоилгидразид может реагировать с альдегидами диастереоселективно. Оба диастереомера могут быть получены из одних и тех же реагентов путем различного выбора растворителей (ДМСО дает один диастереомер, а THF / H2O дает другой), что позволяет предположить, что конформация переходной структуры зависит от растворителя.
Хиральные аллены и имины могут использоваться для асимметричной реакции аза-MBH, катализируемой DABCO. Оптически активный 10-фенилсульфонилизоборнил бута-2,3-диеноат реагирует с арилимином с образованием α-аллениламина диастереоселективным образом (выход 37-57%).

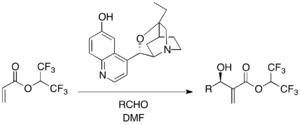
Хиральные третичные аминные катализаторы используются для энантиоселективных реакций MBH. β-ICD, производное алкалоида хинного дерева, широко известно среди катализаторов на основе хинидинового каркаса. 1,1,1,3,3,3, -гексафторизопропилакрилат как активированный алкен и различные альдегиды подвергаются реакции MBH в присутствии β-ICD. Было показано, что фенольный кислород β-ICD играет важную роль в реакции, что подразумевает функцию фрагмента кислоты Бренстеда. β-ICD и его родственные версии являются эффективными катализаторами для различных других субстратов.
Циклопентенон и различные ароматические и алифатические альдегиды подвергаются асимметричной реакции с использованием плоского хирального катализатора DMAP Фу в изопропаноле (выход 54-96%, ее 53-98%). В этом случае для ускорения реакции требовался йодид магния в качестве сокатализатора кислоты Льюиса. P-Хиральные фосфины были исследованы.

Простые диамины также могут быть использованы в качестве катализаторов MBH. Было обнаружено, что метилвинилкетон и различные замещенные бензальдегиды подвергаются асимметричной реакции MBH. Хиральный пирролидиновый катализатор был эффективен для орто- и пара-замещенных электронодефицитных бензальдегидов (выход 75-99%, 8-73% ее).

Хиральные фосфиновые катализаторы MBH часто содержат фрагмент кислоты Бренстеда в своих основных цепях. Например, хиральные фосфины, содержащие основание Льюиса, кислоту Бренстеда и активированное кислотой основание Бренстеда, были разработаны для асимметричной аза-MBH реакции (выход 86-96%, ее 79-92%). Кислотная и основная части Бренстеда были предложены для участия в стабилизации цвиттерионных частиц стереоселективным образом.

Хиральный фосфиновый катализатор на основе BINOL также эффективен для асимметричной реакции аза-MBH N-тозилиминов с активированными алкенами, такими как как метилвинилкетон и фенилакрилат.
Кроме того, особый класс молекул хирального фосфина- скварамида может эффективно катализировать внутримолекулярную асимметричную реакцию MBH. ω-формиленоны реагировали с образованием энантиообогащенных циклических продуктов при температуре окружающей среды (выход 64-98%, 88-93% ее).

Катализаторы на хиральной кислоте Льюиса вызывают интерес, поскольку они могут активировать электроноакцепторную группу энантиоселективным образом. Было показано, что хиральные катионные оксазаборолидиновые катализаторы эффективны в трехкомпонентном связывании α, β-ацетиленовых эфиров, альдегидов и триметилсилилиодида (выход 50-99%, ее 62-94%). Оба энантиомерных продукта могут быть получены с использованием различных энантиомеров катализатора.

Комплекс соли металла и хирального лиганда также является жизнеспособной стратегией. La (OTf) 3 и хиральные лиганды, производные от камфоры, могут вызывать энантиоселективность в реакции MBH, катализируемой DABCO, различных альдегидов и акрилатов (выход 25-97%, 6-95% ее). В этих случаях обычно использовали полидентатные лиганды для хелатирования с металлом, который активирует как цвиттерионный енолят, так и альдегид.

La (O-iPr) 3 и лигандная система, производная от BINOL, в сочетании с каталитическим DABCO, также работает для асимметричной аза-MBH реакции различных N-дифенилфосфиноилиминов и метилакрилата. Арил, гетероарил и алкенилимины подходили для получения хорошего выхода и энантиоселективности.
Хиральные клещевые комплексы палладия (II) действуют как кислота Льюиса в энантиоселективной DABCO-катализируемой аза-MBH реакции акрилонитрила и различных тозилиминов с образованием дают функционализированные α-метилен-β-аминонитрилы (выход 75-98%, ее 76-98%). Ацетат серебра необходим для активации предкатализатора бромида палладия в каталитическом цикле.
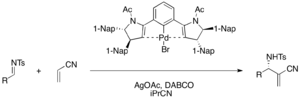
Разнообразные хиральные тиомочевинные катализаторы исследуются на предмет асимметричных реакций MBH. Хиральные тиомочевина и бис (тиомочевина) катализаторы могут быть эффективными в реакциях MBH и аза-MBH, катализируемых DABCO. Катализатор на основе тиомочевины Якобсена осуществляет энантиоселективную реакцию аза-MBH, например (выход 25-49%, ее 87-99%).
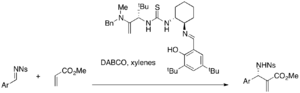
В то время как простая тиомочевина требует наличия нуклеофильного катализатора в сочетании, бифункциональные катализаторы, такие как фосфин-тиомочевины, могут использоваться отдельно для асимметричных реакций MBH. Например, различные акрилаты и ароматические альдегиды реагируют в присутствии этих катализаторов с образованием либо энантиомерных аддуктов MBH (выход 32-96%, 9-77% ее).

Реакция MBH может включать производное пролина в качестве сокатализатора. Было высказано предположение, что имидазольный нуклеофильный катализатор и пролин влияют на реакцию через иминиевый интермедиат. С (S) -пролином и DABCO α-амидосульфоны и α, β-ненасыщенные альдегиды подвергаются высокоэнантиоселективной реакции аза-MBH (выход 46-87%, E / Z 10: 1-19: 1, 82-99% ee).

Реакции MBH широко используются в органическом синтезе. Например, эту реакцию использовали для создания ключевых циклических промежуточных продуктов для синтеза салиноспорамида А, диверсонола и анатоксина-а.


