В химии радикальные часы - это химическое соединение, который помогает в косвенной методологии определить кинетику свободнорадикальной реакции. Само соединение радикальных часов реагирует с известной скоростью, которая обеспечивает калибровку для определения скорости другой реакции.
. Многие органические механизмы включают промежуточные соединения, которые нельзя идентифицировать напрямую, но которые выводятся из реакций захвата. Когда такие промежуточные соединения являются радикалами, их время жизни можно определить по радикальным часам. Альтернативный, возможно, более прямой подход включает образование и выделение промежуточных продуктов с помощью импульсного фотолиза и импульсного радиолиза, но такие методы требуют времени и дорогостоящего оборудования. При косвенном подходе к радикальным часам все еще можно получить относительные или абсолютные константы скорости без необходимости в инструментах или оборудовании, помимо тех, которые обычно необходимы для изучаемой реакции.
Радикальные часовые реакции включают конкуренцию между мономолекулярным радикалом реакция с известной константой скорости и бимолекулярная радикальная реакция с неизвестной константой скорости с образованием нереаранжированных и перегруппированных продуктов. Перегруппировка неупорядоченного радикала U • протекает с образованием R • (часовая реакция) с известной константой скорости (k r). Эти радикалы реагируют с улавливающим агентом, AB, с образованием неупорядоченных и перегруппированных продуктов UA и RA соответственно.
![{\displaystyle {\begin{array}{l}{\ce {U. + AB ->[k_R] {UA} + B.}} \\ {\ bigg \ downarrow} {k_ {r}} \\ {\ ce {R. + AB ->{RA} + B.}} \ End {array}}}]( https://wikimedia.org/api/rest_v1/media/ math / render / svg / 4abb8b060be8190d61bdb4b7df1812862dca45d4 )
Выход двух продуктов можно определить с помощью газовой хроматографии (ГХ) или ядерного магнитного резонанса (ЯМР). концентрация захватывающего агента, известная константа скорости радикальных часов и соотношение продуктов, неизвестная константа скорости может быть установлена косвенно.
Если химическое равновесие существует между U • и R •, перегруппированные продукты являются преобладающими. Поскольку реакция мономолекулярной перегруппировки является первым порядком, а реакция бимолекулярного захвата - второго порядка (обе необратимы), неизвестная константа скорости (k R) можно определить по:
![{\ displaystyle k_ {R} = {\ frac { k_ {r} [{\ ce {UA}}]} {{\ ce {[AB] [RA]}}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/82eef2a563a3b63951d50036a74666ea862bb854)
Движущей силой радикальной реакции часов является их способность y переставить. Некоторые обычные радикальные часы - это радикальные циклизации, раскрытия колец и 1,2-миграции. Две популярные перегруппировки - это циклизация 5-гексенила и раскрытие цикла циклопропилметила:
 |  |
5-гексенильный радикал подвергается циклизации с образованием пятичленного кольца, поскольку это энтропийно и энтальпически Более предпочтительный, чем возможность шестичленного кольца. Константа скорости этой реакции составляет 2,3 × 10 с при 298 К.
Циклопропилметильный радикал претерпевает очень быструю перегруппировку с раскрытием цикла, которая снижает кольцевую деформацию и является энтальпически благоприятной. Константа скорости этой реакции составляет 8,6 × 10 с при 298 К.
Чтобы определить абсолютные константы скорости радикальных реакций, мономолекулярные часы реакции необходимо калибровать для каждой группы радикалов, например первичные алкилы в течение определенного периода времени. С помощью спектроскопии ЭПР можно измерить абсолютные константы скорости мономолекулярных реакций при различных температурах. Затем можно применить уравнение Аррениуса для расчета константы скорости для конкретной температуры, при которой протекают радикальные часы реакции.
При использовании радикальных часов для изучения реакции существует неявное предположение, что скорость перегруппировки радикальных часов такая же, как при определении скорости этой реакции перегруппировки. Теоретическое исследование реакций перегруппировки циклобутилметила и 5-гексенила в различных растворителях показало, что на скорость их реакции очень мало влияет природа растворителя.
Скорости радикальных часов можно настроить на увеличение или уменьшение в зависимости от того, какие типы заместителей присоединены к радикальным часам. На рисунке ниже скорости радикальных часов показаны с различными заместителями, присоединенными к часам.
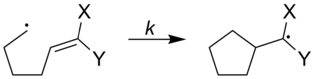 | ||
| X | Y | k (s) |
|---|---|---|
| Ph | Ph | 5x10 |
| OCH 3 | H | 1.4x10 |
| OCH 3 | CN | 2,5x10 |
| CN | H | 1,6x10 |
Путем выбора среди общих классов радикальных часов и конкретных заместителей на них можно выбрать константу скорости, подходящую для изучения реакций, имеющих широкий диапазон скоростей. Реакции, имеющие скорости в диапазоне от 10 до 10 Мс, были изучены с использованием радикальных часов.
Радикальные часы используются для восстановления алкилгалогенидов. с нафталинидом натрия, реакция енонов, перегруппировка Виттига, реакции восстановительного элиминирования соединений диалкилртути, диоксиран дигидроксилирование и электрофильное фторирование.