| Формилирование Гаттермана | |
|---|---|
| Названо в честь | Людвига Гаттермана |
| Тип реакции | Реакция замещения |
| Идентификаторы | |
| RSC ID онтологии | RXNO: 0000139 |
реакция Гаттермана (также известная как формилирование Гаттермана и синтез салицилальдегида Гаттерманна ) представляет собой химическую реакцию, в которой ароматические соединения формилируют смесью цианистого водорода (HCN) и хлористый водород (HCl) в присутствии катализатора кислота Льюиса , такого как AlCl 3. Она названа в честь немецкого химика Людвига Гаттермана и похожа на реакцию Фриделя – Крафтса.
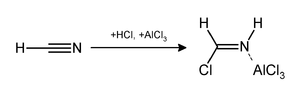

. Реакцию можно упростить, заменив комбинацию HCN / AlCl 3 на цианид цинка. Несмотря на высокую токсичность, Zn (CN) 2 является твердым веществом, поэтому с ним безопаснее работать, чем с газообразным HCN. Zn (CN) 2 реагирует с HCl с образованием основного реагента HCN и Zn (CN) 2, который служит катализатором на основе кислоты Льюиса на месте. Примером метода Zn (CN) 2 является синтез из мезитилена.
| Формилирование Гаттермана – Коха | |
|---|---|
| Названо в честь | Людвига Гаттермана. Юлиус Арнольд Кох |
| Тип реакции | Реакция замещения |
Реакция Гаттермана – Коха, названная в честь немецких химиков Людвига Гаттермана и Юлиуса Арнольда Коха, представляет собой вариант реакции Гаттермана, в котором монооксид углерода (CO) используется вместо цианида водорода.

В отличие от реакции Гаттермана, эта реакция не применима к фенолу и фенолу эфир субстратов. Хотя крайне нестабильный формилхлорид изначально постулировался как промежуточный, сейчас считается, что формильный катион (т.е. протонированный монооксид углерода), [HCO], вступает в реакцию непосредственно с ареном без начального образования формилхлорида. Кроме того, когда хлорид цинка используется в качестве кислоты Льюиса вместо, например, хлорида алюминия, или когда монооксид углерода не используется при высоком давлении, присутствие следов хлорида меди (I) или часто требуется сокатализатор хлорида никеля (II). Сокатализатор переходного металла может выступать в качестве «носителя», сначала образуя реакцию с CO с образованием карбонильного комплекса, который затем превращается в активный электрофил.