 | |
 | |
| Идентификаторы | |
|---|---|
| Номер CAS | |
| Свойства | |
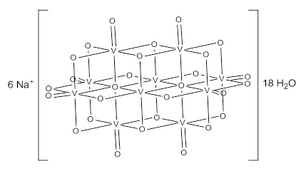
| Химическая формула | Na6[V10O28] |
| Молярная масса | 1419,6 г |
| Внешний вид | твердое вещество оранжевого цвета |
| Если не указано иное, данные приведены для материалов в их стандартном состоянии (при 25 ° C [77 ° F], 100 кПа). | |
| Информационное окно ссылки | |
декаванадат натрия описывает любой член семейства неорганических соединений с формулой Na 6[V10O28] (H 2O)n. Это натриевые соли оранжевого цвета декаванадат анион [V10O28]. Было выделено и изучено множество других солей декаванадата. с 1956 г., когда он был впервые охарактеризован.
Получение декаванадата достигается подкислением водного раствора орто- ванадата :
Образование декаванадата оптимизируется за счет поддержания диапазона pH 4–7. Типичные побочные продукты включают метаванадат, [VO 3 ] и гексаванадат, [V 6O16], ионы.
Ион декаванадата состоит из 10 конденсированных VO 6 октаэдров и имеет симметрию D 2h. Структура Na 6[V10O28] · 18H 2 O была подтверждена с помощью рентгеновской кристаллографии.
 Рис. 1. Структура декаванадат-иона с указанными эквивалентными атомами V и O
Рис. 1. Структура декаванадат-иона с указанными эквивалентными атомами V и O декаванадат-анионы содержат три набора эквивалентных атомов V (см. рис. 1). К ним относятся два центральных октаэдра VO 6 (V c) и по четыре каждой периферийной тетрагонально-пирамидальной группы VO 5 (V a и V b). Есть семь уникальных групп атомов кислорода (обозначенных от A до G). Два из этих (A) соединяют шесть V-центров, четыре (B) соединяют три V-центра, четырнадцать из них (C, D и E) охватывают края между парами V-центров, а восемь (F и G) являются периферийными.
степень окисления ванадия в декаванадате составляет +5.
Водные соединения ванадата (V) подвергаются различным реакциям самоконденсации. В зависимости от pH основные анионы ванадата в растворе включают VO 2(H2O)4, VO 4, V 2O7, V 3O9, V 4O12и V 10O26. Анионы часто обратимо протонируют. Декаванадат образуется в соответствии с этим равновесием:
Структура различные состояния протонирования декаванадат-иона исследовали с помощью спектроскопии ЯМР 18V. Каждый вид подает три сигнала; со слегка изменяющимися химическими сдвигами около -425, -506 и -523 м.д. относительно окситрихлорида ванадия ; предполагая, что происходит быстрый обмен протонами, приводящий к одинаково симметричным видам. Было показано, что три протонирования декаванадата происходят в мостиковых кислородных центрах, обозначенных буквами B и C на рисунке 1.
декаванадат наиболее стабилен в области pH 4–7. Растворы ванадата становятся ярко-оранжевыми при pH 6,5, что указывает на присутствие декаванадата. Остальные ванадаты бесцветны. При pH ниже 2,0 коричневый V 2O5выпадает в осадок в виде гидрата.
Были охарактеризованы многие соли декаванадата. Соли декаванадата NH 4, Ca, Ba, Sr и группы I получают посредством кислотно-основной реакции между V 2O5и оксидом, гидроксидом, карбонатом или гидрокарбонатом желаемого положительного иона.
Другие декаванадаты:
Девакаванадаты природного происхождения включают: