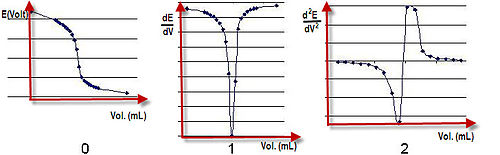
 Измерения, первая и вторая производная при потенциометрическом титровании.
Измерения, первая и вторая производная при потенциометрическом титровании. Потенциометрическое титрование - это метод, аналогичный прямому титрованию реакции окислительно-восстановительной. Это полезное средство для характеристики кислоты. Индикатор не используется; вместо этого потенциал измеряется на аналите, обычно в растворе электролита. Для этого используются два электрода, индикаторный электрод (стеклянный электрод и индикаторный электрод с ионами металла) и электрод сравнения. Обычно используемые электроды сравнения представляют собой водородные электроды, каломельные электроды и электроды из хлорида серебра. Индикаторный электрод образует электрохимическую половину ячейки с интересующими ионами в тестовом растворе. Электрод сравнения образует вторую половину ячейки.
Общий электрический потенциал рассчитывается как E cell = E ind - E ref + E sol. E sol - падение потенциала в исследуемом растворе между двумя электродами. E ячейка записывается с интервалами по мере добавления титранта. Можно нарисовать график зависимости потенциала от добавленного объема, и конечная точка реакции находится на полпути между скачком напряжения. E ячейка зависит от концентрации интересующих ионов, с которыми контактирует индикаторный электрод. Например, электродная реакция может быть
M + ne ----->M
Когда концентрация M изменяется, ячейка E изменяется соответственно. Таким образом, потенциометрическое титрование включает измерение E ячейки с добавлением титранта. Типы потенциометрического титрования: кислотно-основное титрование (общая щелочность и общая кислотность), окислительно-восстановительное титрование (HI / HY и церат), (галогениды) и комплексометрическое титрование (бесплатный ЭДТА и Antical # 5).
Первое потенциометрическое титрование было проведено в 1893 году Робертом Берендом в Институте Оствальда в Лейпциге. Он титровал ртуть хлоридом, бромидом калия и иодидом калия. Он использовал ртутный электрод вместе с электродом сравнения из нитрата ртути. Он обнаружил, что в ячейке, состоящей из нитрата ртути и нитрата ртути / ртути, начальное напряжение равно 0. Если хлорид калия добавляется к нитрату ртути с одной стороны, выпадает хлорид ртути (I). Это снизило осмотическое давление ионов ртути (I) на стороне и создает разность потенциалов. Эта разность потенциалов медленно увеличивается по мере добавления хлорида калия, но затем увеличивается быстрее. Он обнаружил, что наибольшая разность потенциалов достигается, когда весь нитрат ртути осаждается. Это использовалось для определения конечных точек титрования.
Затем Вильгельм Боттгер разработал инструмент потенциометрического титрования, работая в Институте Оствальда. Он использовал потенциометрическое титрование, чтобы наблюдать различия в титровании сильных и слабых кислот, а также поведение многоосновных кислот. Он представил идею использования потенциометрического титрования для кислот и оснований, которые нельзя титровать в сочетании с колориметрическим индикатором.
Потенциометрическое титрование впервые было использовано для окислительно-восстановительного титрования Кротогино. Он титровал галогенид-ионы перманганатом калия, используя блестящий платиновый электрод и каломельный электрод. Он говорит, что если к восстанавливающему раствору добавить окислитель, то равновесие между восстанавливающим веществом и продуктом реакции сместится в сторону продукта реакции. Потенциал изменяется очень медленно, пока количество восстанавливающего вещества не станет очень небольшим. После добавления небольшого количества раствора для титрования произойдет сильное изменение потенциала, так как окончательные количества восстановителя будут удалены, а потенциал будет соответствовать только окислителю. Это большое увеличение разности потенциалов означает конечную точку реакции.