| ксилозоизомераза | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 Тетрамер D-ксилозоизомеразы из Streptomyces rubiginosus PDB 2glk. Один мономер окрашен вторичной структурой, чтобы выделить архитектуру цилиндра TIM. Тетрамер D-ксилозоизомеразы из Streptomyces rubiginosus PDB 2glk. Один мономер окрашен вторичной структурой, чтобы выделить архитектуру цилиндра TIM. | |||||||||
| Идентификаторы | |||||||||
| Номер EC | 5.3.1.5 | ||||||||
| Номер CAS | 9023-82-9 | ||||||||
| Базы данных | |||||||||
| IntEnz | представление IntEnz | ||||||||
| BRENDA | запись BRENDA | ||||||||
| ExPASy | представление NiceZyme | ||||||||
| KEGG | запись KEGG | ||||||||
| MetaCyc | метаболический путь | ||||||||
| профиль PRIAM | |||||||||
| PDB структуры | RCSB PDB PDBe PDBsum | ||||||||
| Онтология генов | AmiGO / QuickGO | ||||||||
| |||||||||
В энзимологии ксилозоизомераза (EC 5.3.1.5 ) является фермент, который катализирует взаимное превращение D-ксилозы и D-ксилулозы. Этот фермент принадлежит к семейству изомераз, в частности тех внутримолекулярных оксидоредуктаз, взаимопревращающих альдозы и кетозы. Изомераза наблюдалась почти у сотни видов бактерий. Ксилоза -изомеразы также обычно называют фруктозо-изомеразами из-за их способности взаимно превращать глюкозу и фруктозу. систематическое название этого класса ферментов - D-ксилозаальдоз-кетозо-изомераза. Другие широко используемые названия включают D-ксилозоизомеразу, D-ксилозокетоизомеразу и D-ксилозокетол-изомеразу.
Активность D-ксилозы изомераза была впервые обнаружена Мицухаши и Лэмпеном в 1953 году у бактерии Lactobacillus pentosus. Искусственное производство с помощью преобразованной E.coli также оказалось успешным. В 1957 году активность D-ксилозоизомеразы в превращении D-глюкозы в D-фруктозу была отмечена Куи и Маршаллом. В настоящее время известно, что изомеразы обладают широкой субстратной специфичностью. Большинство пентоз и некоторые гексозы являются субстратами для D-ксилозоизомеразы. Некоторые примеры включают: D-рибозу, L-арабинозу, L-рамозу и D-аллозу.
Превращение глюкозы во фруктозу с помощью ксилозоизомеразы было впервые запатентовано в 1960-х годах, однако этот процесс не был промышленно жизнеспособным. поскольку ферменты были суспендированы в растворе, и переработка фермента была проблематичной. Неподвижная изомераза ксилозы, фиксируемая на твердой поверхности, была впервые разработана Таканаши в Японии. Эти разработки были важны для разработки промышленных процессов ферментации, используемых при производстве кукурузного сиропа с высоким содержанием фруктозы.
Третичная структура была определена для нескольких изомераз ксилозы из микробов, начиная с середины 1980-х годов (Streptomyces olivochromogenes in 1988, Streptomyces violaceoniger в 1988, Streptomyces rubiginosus в 1984, Arthrobacter B3728 в 1986, Actinoplanes missouriensis в 1992 и Clostridium thermosulfurogenes в 1990).
Этот фермент участвует в пентозе и взаимные превращения глюкуроната и метаболизм фруктозы и маннозы. По данным Международного общества редких сахаров, наиболее биологически доступными сахарами являются: глюкоза, галактоза, манноза, фруктоза, ксилоза, рибоза и L-арабиноза. Двадцать гексоз и девять пентоз, включая ксилулозу, считались «редкими сахарами». Следовательно, D-ксилозоизомераза используется для производства этих редких сахаров, которые, несмотря на их низкое содержание, имеют очень важное применение в биологии.
Ксилозоизомераза, которую можно выделить из красного китайского рисового вина, которое содержит бактерии Lactobacillus xylosus. Эта бактерия была ошибочно классифицирована как L. plantarum, которая обычно растет на сахаре L-арабиноза и редко растет на D-ксилозе. Было признано, что L. xylosus отличается своей способностью расти на D-ксилозе. Ксилозоизомераза L. xylosus имеет молекулярную массу около 183000 дальтон. Оптимальный pH для роста L. lactis составляет около 7,5, однако такие штаммы, как фермент ксилоза L.brevis, предпочитают более щелочную среду. Штамм L. lactis стабилен в диапазоне pH от 6,5 до 11,0, а фермент L. brevis, который менее устойчив к изменениям pH, проявляет активность в диапазоне pH от 5,7 до 7,0. Кей Ю. и Норитака Т. также провели тепловые испытания, и было обнаружено, что изомераза ксилозы является термостойкой примерно до 60 градусов Цельсия
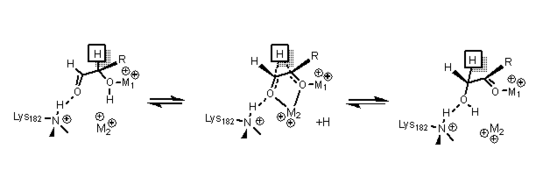
Ксилозоизомераза имеет структуру, которая основан на восьми альфа / бета-барабанах, которые создают активный центр, содержащий два двухвалентных иона магния. Ферменты ксилозоизомеразы проявляют цилиндрическую складку TIM с активным центром в центре цилиндра и тетрамерную четвертичную структуру. Структуры PDB доступны по ссылкам в информационном окне справа. Белок представляет собой тетрамер, в котором парные цилиндры почти соосны, которые образуют две полости, в которых оба двухвалентных металла связаны с одной из двух полостей. Металлы имеют октаэдрическую геометрию. Металлический участок 1 плотно связывает субстрат, в то время как второй участок металла связывает субстрат слабо. Оба имеют общий кислотный остаток глутаминовой кислоты 216 фермента, который связывает два катиона. Две основные аминокислоты окружают отрицательно заряженные лиганды, чтобы нейтрализовать их. Вторая полость обращена к металлической полости, и обе полости имеют один и тот же путь доступа. Вторая полость является гидрофобной по своей природе и имеет важный остаток гистидина, который активируется остатком аспартата, который связан с ним водородной связью. Этот остаток гистидина важен для изомеризации глюкозы.
При изомеризации глюкозы гистидин 53 используется для катализирования переноса протона от O1 к O5; Схема механизма открывания кольца представлена ниже. Первый металл, упомянутый ранее, координирует с O3 и O4 и используется для стыковки субстрата.

При изомеризации ксилозы данные кристаллов показали, что сахар ксилозы связывается с ферментом в открытом цепочка соответствие. Металл 1 связывается с O2 и O4, и однажды связанный металл 2 связывается с O1 и O2 в переходном состоянии, и эти взаимодействия вместе с остатком лизина помогают катализировать гидридный сдвиг, необходимый для изомеризации. Переходное состояние состоит из высокоэнергетического иона карбония, который стабилизируется посредством всех взаимодействий металла с сахарным субстратом.
Наиболее широко используемым применением этого фермента является в превращении глюкозы во фруктозу с образованием кукурузного сиропа с высоким содержанием фруктозы (HFCS). Существует три основных этапа получения HFCS из крахмала:
Процесс осуществляется в биореакторы при 60–65 ° C. Ферменты становятся инактивированными при таких высоких температурах, и одним из направлений исследований является разработка более термостабильных версий ксилозоизомеразы и других ферментов в процессе. Ферменты обычно иммобилизуют для увеличения производительности; Еще одним направлением исследований стало создание более эффективных способов сделать это.
Ксилозоизомераза - один из ферментов, используемых бактериями в природе для использования целлюлозы в пищу, и еще один фокус на промышленных и академических исследованиях. разрабатывает версии ксилозоизомеразы, которые могут быть полезны в производстве биотоплива.
Продукты, содержащие ксилозо-изомеразу, продаются как без рецепта пищевые добавки для борьбы с мальабсорбцией фруктозы, в основном в Европе и под торговыми марками, включая Fructaid, Fructease и Fructosin. Помимо общих опасений по поводу эффективности безрецептурных ферментов, в настоящее время существует очень ограниченное количество исследований, касающихся ксилозо-изомеразы в качестве пищевой добавки, с единственным научным исследованием, показывающим положительное влияние на тошноту и боль в животе, вызванную мальабсорбцией, но ни одного исследования на вздутие живота.