 Принципиальная схема гальванической сваи медь - цинк. Медный и цинковый диски были разделены картонными или войлочными прокладками, пропитанными соленой водой (электролитом). Оригинальные сваи Вольты содержали дополнительный цинковый диск внизу и дополнительный медный диск вверху. Позже было показано, что в них нет необходимости.
Принципиальная схема гальванической сваи медь - цинк. Медный и цинковый диски были разделены картонными или войлочными прокладками, пропитанными соленой водой (электролитом). Оригинальные сваи Вольты содержали дополнительный цинковый диск внизу и дополнительный медный диск вверху. Позже было показано, что в них нет необходимости.  Гальваническая батарея, выставленная в Темпио Вольтиано (Храм Вольты) недалеко от дома Вольты в Комо, Италия
Гальваническая батарея, выставленная в Темпио Вольтиано (Храм Вольты) недалеко от дома Вольты в Комо, Италия  Воспроизведение первой гальванической батареи
Воспроизведение первой гальванической батареи Гальванической батареи была первая электрическая батарея, которая могла непрерывно обеспечивать электрический ток в цепи. Он был изобретен итальянским физиком Алессандро Вольта, опубликовавшим свои эксперименты в 1799 году. Затем гальванический котел позволил сделать ряд других открытий, включая электрическое разложение (электролиз ) воды на кислород. и водород Уильямом Николсоном и Энтони Карлайлом (1800) и открытие или выделение химических элементов натрия (1807), калий (1807), кальций (1808), бор (1808), барий (1808), стронций (1808) и магний (1808) от Хамфри Дэви.
Вся электротехническая промышленность 19-го века питалась от батареек, аналогичных батареям Вольта (например, элемент Даниэля и элемент Гроув ) до появления динамо (электрического генератора) в 1870-х годах.
Изобретение Вольта было основано на открытии Луиджи Гальвани в 1780-х годах о том, как цепь из двух металлов и лягушачьей лапы может вызвать реакцию лягушачьей лапы. Вольта продемонстрировал в 1794 году, что когда два металла и пропитанная рассолом ткань или картон соединяются в цепь, они производят электрический ток. В 1800 году Вольта сложил несколько пар чередующихся дисков меди (или серебра ) и цинка (электродов ), разделенных тканью или пропитанным картоном. в рассоле (электролит ) для увеличения проводимости электролита. Когда верхний и нижний контакты были соединены проводом, электрический ток протекал через гальваническую батарею и соединительный провод.
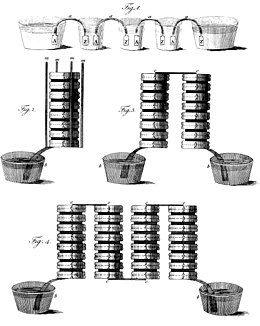 Чертеж гальванической сваи в различных конфигурациях, из письма, отправленного от Алессандро Вольта Джозефу Бэнксу.
Чертеж гальванической сваи в различных конфигурациях, из письма, отправленного от Алессандро Вольта Джозефу Бэнксу.20 марта 1800 г., Алессандро Вольта написал Лондонскому Королевскому обществу, чтобы описать технику производства электрического тока с помощью его устройства. Узнав о гальванической батарее, Уильям Николсон и Энтони Карлайл использовали ее, чтобы открыть электролиз воды. Хамфри Дэви показал, что электродвижущая сила, которая управляет электрическим током через цепь, содержащую единственный гальванический элемент, была вызвана химической реакцией, а не разницей напряжений между двумя металлами.. Он также использовал гальваническую батарею для разложения химикатов и производства новых химикатов. Уильям Хайд Волластон показал, что электричество от гальванических свай имеет те же эффекты, что и электричество, произведенное трением. В 1802 году Василий Петров использовал гальванические сваи для открытия и исследования эффектов электрической дуги.
Хэмфри Дэви и Эндрю Кросс были одними из первых, кто разработал большие гальванические сваи. Дэви использовал сваю из 2000 пар, изготовленную для Королевского института в 1808 году, чтобы продемонстрировать углеродный дуговый разряд и выделить пять новых элементов: барий, кальций, бор, стронций и магний.
Поскольку Вольта считал, что электродвижущая сила возникает при контакте двух металлов, сваи Вольта имели другую конструкцию, чем современный дизайн, показанный на этой странице. Его сваи имели один дополнительный диск из меди вверху, контактирующий с цинком, и один дополнительный диск из цинка внизу, контактирующий с медью. Развивая работу Вольты и работу его наставника Хамфри Дэви в области электромагнетизма, Майкл Фарадей в своих экспериментах с электричеством использовал как магниты, так и гальваническую батарею. Фарадей считал, что все «электричество», изучаемое в то время (гальваническое, магнитное, тепловое и животное), было одним и тем же. Его работа по доказательству этой теории привела его к предложению двух законов электрохимии, которые находились в прямом противоречии с нынешними научными представлениями того времени, изложенными Вольтой тридцатью годами ранее. Благодаря их вкладу в понимание этой области исследований, Фарадей и Вольта считаются одними из отцов электрохимии. Слова «электрод» и «электролит», использованные выше для описания работы Вольта, принадлежат Фарадею.
В период с начала XIX века был изобретен ряд высоковольтных сухих свай. века и 1830-х годов в попытке определить источник электричества мокрой гальванической батареи и, в частности, поддержать гипотезу Вольта о контактном напряжении. Действительно, сам Вольта экспериментировал с стопкой картонных дисков, у которой высохли, скорее всего, случайно.
Первым был опубликован Иоганн Вильгельм Риттер в 1802 году, хотя и в малоизвестном журнале, но в течение следующего десятилетия об этом неоднократно объявляли как о новом открытии. Одной из форм сухого ворса является ворс Замбони. Фрэнсис Рональдс в 1814 году был одним из первых, кто осознал, что сухие сваи также работают за счет химической реакции, а не контакта металла с металлом, хотя коррозия не была заметна из-за генерируемых очень малых токов.
Сухая свая может рассматриваться как предок современной сухой батареи.
Прочность сваи выражается в единицах электродвижущей силы, или ЭДС, выраженная в вольтах. Теория Алессандро Вольта о контактном напряжении предполагает, что ЭДС, которая управляет электрическим током через цепь, содержащую гальванический элемент, возникает на контакте между двумя металлами. Вольта не считал важным электролит, которым обычно был рассол. Однако вскоре химики поняли, что вода в электролите участвует в химических реакциях котла и привела к выделению водорода из медного или серебряного электрода.
Современное понимание атома работы ячейки с цинковым и медным электродами, разделенными электролитом, заключается в следующем. Когда ячейка обеспечивает электрический ток через внешнюю цепь, металлический цинк на поверхности цинкового анода окисляется и растворяется в электролите в виде электрически заряженных ионов (Zn), оставляя 2 отрицательно заряженных электроны (. e.) в металле:
Эта реакция называется окислением. Пока цинк поступает в электролит, два положительно заряженных иона водорода (H) из электролита принимают два электрона на поверхности медного катода, восстанавливаются и образуют незаряженную молекулу водорода (H 2):
Эта реакция называется восстановлением. Электроны, используемые из меди для образования молекул водорода, состоят из внешнего провода или цепи, которая соединяет его с цинком. Молекулы водорода, образующиеся на поверхности меди в результате реакции восстановления, в конечном итоге уносятся пузырями в виде газообразного водорода.
Можно заметить, что глобальная электрохимическая реакция не сразу включает электрохимическую пару Cu / Cu (Ox / Red), соответствующую медному катоду. Таким образом, металлический медный диск служит здесь только как «химически инертный» благородный металлический проводник для переноса электронов в цепи и химически не участвует в реакции в водной фазе. Медный электрод можно заменить в системе любым достаточно благородным / инертным металлическим проводником (Ag, Pt, нержавеющая сталь, графит и т. Д.). Глобальную реакцию можно записать следующим образом:
Это удобно стилизовано с помощью обозначения электрохимической цепи:
, в котором вертикальная черта каждый раз представляет границу раздела. Двойная вертикальная полоса представляет границы раздела, соответствующие электролиту, пропитывающему пористый картонный диск.
Когда ток не поступает из котла, каждая ячейка, состоящая из цинка / электролита / меди, вырабатывает 0,76 В с солевым электролитом. Напряжения от ячеек в свае складываются, поэтому шесть ячеек на диаграмме выше генерируют электродвижущую силу 4,56 В.