 | |
| Имена | |
|---|---|
| Имена ИЮПАК Диоксид урана Оксид урана (IV) | |
| Другие имена Урания Оксид урана | |
| Идентификаторы | |
| Количество CAS | |
| 3D модель ( JSmol ) | |
| ChemSpider | |
| ECHA InfoCard | 100.014.273 |
| Номер ЕС | |
| PubChem CID | |
| Номер RTECS | |
| UNII | |
| Панель управления CompTox ( EPA) | |
ИнЧИ
| |
Улыбки
| |
| Характеристики | |
| Химическая формула | UO 2 |
| Молярная масса | 270,03 г / моль |
| Появление | черный порошок |
| Плотность | 10,97 г / см 3 |
| Температура плавления | 2865 ° С (5189 ° F, 3138 К) |
| Растворимость в воде | нерастворимый |
| Состав | |
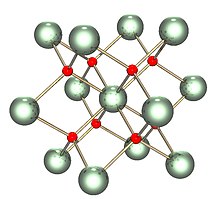
| Кристальная структура | Флюорит (кубический), cF12 |
| Космическая группа | Фм 3 м, №225 |
| Постоянная решетки | а = 547,1 пм |
| Координационная геометрия | Тетраэдрический (O 2-); кубический (U IV) |
| Термохимия | |
| Стандартная мольная энтропия ( S | 78 Дж моль −1 K −1 |
| Std энтальпия формации (Δ F H ⦵298) | −1084 кДж моль −1 |
| Опасности | |
| Паспорт безопасности | ICSC 1251 |
| Пиктограммы GHS |    |
| Сигнальное слово GHS | Опасность |
| Формулировки опасности GHS | H300, H330, H373, H400, H410, H411 |
| Меры предосторожности GHS | Р260, Р264, Р270, Р271, Р273, Р284, Р301 + 310, Р304 + 340, P310, P314, P320, P321, P330, P391, P403 + 233, Р405, Р501 |
| NFPA 704 (огненный алмаз) |  4 0 0 OX 4 0 0 OX |
| точка возгорания | N / A |
| Родственные соединения | |
| Связанные оксиды урана | Октоксид триурана Триоксид урана |
| Если не указано иное, данные приведены для материалов в их стандартном состоянии (при 25 ° C [77 ° F], 100 кПа). | |
| | |
| Ссылки на инфобоксы | |
Диоксид урана или оксид урана (IV), ( U O 2), также известный как Урания или уранил оксид, представляет собой оксид из урана, и является черным, радиоактивным, кристаллический порошком, который естественно происходит в минеральном уранините. Он используется в топливных стержнях ядерных реакторов. В качестве МОКС-топлива используется смесь диоксидов урана и плутония. До 1960 года он использовался как желтый и черный цвет в керамической глазури и стекле.
Диоксид урана получают путем уменьшения триоксида урана с водородом.
Эта реакция играет важную роль в создании ядерного топлива путем ядерной переработки и обогащения урана.
Твердое тело изоструктурно (имеет ту же структуру, что и) флюориту ( фторид кальция ), где каждый U окружен восемью ближайшими соседями O в кубической структуре. Кроме того, такое же строение имеют диоксиды церия, тория, плутония и нептуния. Никакие другие элементарные диоксиды не имеют структуры флюорита. При плавлении измеренная средняя координация UO снижается с 8 в твердом кристаллическом ( кубики UO 8) до 6,7 ± 0,5 (при 3270 K) в расплаве. Модели, совместимые с этих измерений показывают расплав состоит в основном из UO 6 и UO 7 многогранные единиц, где примерно 2 / 3 из соединений между многогранников являются совместное использование угловой и 1 / 3 совместно используют край.

Диоксид урана

Таблетки из спеченного диоксида урана
Диоксид урана окисляется при контакте с кислородом до октаоксида триурана.
Электрохимии диоксида урана была подробно исследованы как гальваническая коррозия диоксида урана управляет скоростью, при которой используемом топливе ядерного растворяется. См. Отработанное ядерное топливо для получения дополнительной информации. Вода увеличивает скорость окисления плутония и металлов урана.
Диоксид урана карбонизируется при контакте с углеродом, образуя карбид урана и монооксид углерода.
Этот процесс необходимо проводить в среде инертного газа, поскольку карбид урана легко окисляется обратно в оксид урана.
UO 2 используется в основном как ядерное топливо, в частности как UO 2 или как смесь UO 2 и PuO 2 ( диоксид плутония ), называемая смешанным оксидом ( МОКС-топливо ), в виде топливных стержней в ядерных реакторах.
Следует отметить, что теплопроводность диоксида урана является очень низким по сравнению с ураном, нитрид урана, карбид урана и циркония облицовочного материала. Такая низкая теплопроводность может привести к локальному перегреву в центрах топливных таблеток. На приведенном ниже графике показаны различные температурные градиенты в различных топливных смесях. Для этих видов топлива плотность тепловой энергии одинакова, а диаметр всех гранул одинаков.

Топливные таблетки из оксида урана

Контейнеры для исходного материала для производства топливных таблеток из диоксида урана на заводе в России

Зависимость теплопроводности металлического циркония и диоксида урана от температуры
 Воспроизвести медиа Счетчик Гейгера (комплект без корпуса), слышащий реакцию на оранжевый осколок Fiestaware.
Воспроизвести медиа Счетчик Гейгера (комплект без корпуса), слышащий реакцию на оранжевый осколок Fiestaware. Оксид урана (уран) использовался для окрашивания стекла и керамики до Второй мировой войны, и до тех пор, пока не было обнаружено применение радиоактивности, это было его основным применением. В 1958 году военные США и Европы снова разрешили его коммерческое использование в качестве обедненного урана, и его использование снова началось в более ограниченных масштабах. Керамические глазури на основе урана имеют темно-зеленый или черный цвет при обжиге в восстановительном режиме или при использовании UO 2 ; чаще всего его используют при окислении для получения ярко-желтой, оранжевой и красной глазури. Fiestaware оранжевого цвета - хорошо известный пример продукта с глазурью цвета урана. Урановое стекло имеет цвет от бледно-зеленого до желтого цвета и часто имеет сильные флуоресцентные свойства. Урания также использовался в составах эмали и фарфора. С помощью счетчика Гейгера можно определить, содержит ли уранию глазурь или стекло, произведенные до 1958 года.
До осознания вреда излучения уран использовался в искусственных зубах и зубных протезах, поскольку его легкая флуоресценция делала протезы более похожими на настоящие зубы в различных условиях освещения.
Обедненный UO 2 (DUO 2) можно использовать в качестве материала для защиты от излучения. Например, DUCRETE - это «тяжелый бетон » материал, в котором гравий заменен заполнителем диоксида урана; этот материал исследуется для использования в контейнерах для радиоактивных отходов. Контейнеры также могут быть изготовлены из DUO 2 - стального кермета, композитного материала, состоящего из агрегата диоксида урана, служащего радиационной защитой, графита и / или карбида кремния, служащего поглотителем и замедлителем нейтронного излучения, и стали в качестве матрицы, чья высокая теплоотдача проводимость позволяет легко отводить остаточное тепло.
Истощенная двуокись урана может быть также использована в качестве катализатора, например, для деградации летучих органических соединений в газовой фазе, окисления от метана до метанола, и удаления серы из нефти. Он имеет высокую эффективность и долгосрочную стабильность при использовании для уничтожения ЛОС по сравнению с некоторыми коммерческими катализаторами, такими как катализаторы из драгоценных металлов, TiO 2 и Co 3 O 4. В этой области проводится много исследований, причем DU является предпочтительным компонентом урана из-за его низкой радиоактивности.
Исследуется возможность использования диоксида урана в качестве материала для аккумуляторных батарей. Батареи могут иметь высокую плотность мощности и потенциал 4,7 В на элемент. Другое исследуемое применение - фотоэлектрохимические элементы для производства водорода с помощью солнечной энергии, где UO 2 используется в качестве фотоанода. Раньше диоксид урана также использовался в качестве проводника тепла для ограничения тока (резистор URDOX), что было первым использованием его полупроводниковых свойств.
Диоксид урана также является самым сильным известным пьезомагнетиком в антиферромагнитном состоянии, наблюдаемом при криогенных температурах ниже 30 кельвинов. UO 2 демонстрирует линейную магнитострикцию, меняющую знак со знаком приложенного магнитного поля, и переключение магнитоупругой памяти при магнитных полях около 180 000 Э.
Ширина запрещенной зоны двуокиси урана сравнимы с таковыми кремния и арсенида галлия, вблизи оптимального для эффективности против запрещенной зоны кривой для поглощения солнечного излучения, предполагая его возможное использование в очень эффективных солнечных элементов на основе диода Шоттки структуры; он также поглощает на пяти различных длинах волн, включая инфракрасный, что еще больше повышает его эффективность. Его собственная проводимость при комнатной температуре примерно такая же, как у монокристаллического кремния.
Диэлектрическая проницаемость диоксида урана составляет около 22, что почти в два раза выше, чем кремний (11.2) и GaAs (14.1). Это преимущество перед Si и GaAs при создании интегральных схем, поскольку оно может обеспечить интеграцию с более высокой плотностью при более высоких напряжениях пробоя и с меньшей восприимчивостью к туннельному пробою КМОП.
Коэффициент Зеебека диоксида урана при комнатной температуре составляет около 750 мкВ / К, что значительно выше 270 мкВ / К теллурида таллия-олова (Tl 2 SnTe 5) и теллурида германия таллия (Tl 2 GeTe 5) и висмута - теллуровые сплавы, другие перспективные материалы для термоэлектрической энергетики и элементы Пельтье.
Радиоактивного распада воздействие 235 U и 238 ¯u на его полупроводниковые свойства не измеряли, как в 2005 году из - за медленной скорости распада этих изотопов, оно не должно значительно влиять на свойства диоксида урана солнечных батарей и термоэлектрических устройств, но может стать важным фактором для микросхем СБИС. По этой причине необходимо использование обедненного оксида урана. Захват альфа-частиц, испускаемых во время радиоактивного распада в виде атомов гелия в кристаллической решетке, также может вызывать постепенные долгосрочные изменения ее свойств.
Стехиометрии материала значительно влияет на его электрические свойства. Например, электропроводность UO 1.994 на порядки ниже при более высоких температурах, чем проводимость UO 2.001.
Диоксид урана, как и U 3 O 8, представляет собой керамический материал, способный выдерживать высокие температуры (около 2300 ° C по сравнению с максимум 200 ° C для кремния или GaAs), что делает его пригодным для высокотемпературных применений, таких как термофотовольтаические устройства.
Диоксид урана также устойчив к радиации повреждения, что делает его полезным для Rad-трудно устройств для специальных военных и аэрокосмических применений.
Диод Шоттки из U 3 O 8 и PNP - транзистор из UO 2 были успешно изготовлены в лаборатории.
Известно, что диоксид урана абсорбируется в легких путем фагоцитоза.