| UDP-глюкоза 4- эпимераза | |||||||||
|---|---|---|---|---|---|---|---|---|---|
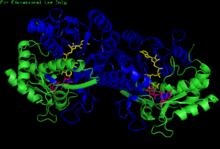 H. sapiens Гомодимер UDP-глюкозы 4-эпимеразы, связанный с NADH и UDP-глюкозой. Домены: N-терминал и C-терминал. H. sapiens Гомодимер UDP-глюкозы 4-эпимеразы, связанный с NADH и UDP-глюкозой. Домены: N-терминал и C-терминал. | |||||||||
| Идентификаторы | |||||||||
| Номер EC | 5.1.3.2 | ||||||||
| Номер CAS | 9032-89-7 | ||||||||
| Базы данных | |||||||||
| IntEnz | IntEnz просмотр | ||||||||
| BRENDA | запись BRENDA | ||||||||
| ExPASy | NiceZyme view | ||||||||
| KEGG | запись KEGG | ||||||||
| MetaCyc | метаболический путь | ||||||||
| PRIAM | профиль | ||||||||
| PDB структуры | RCSB PDB PDBe PDBsum | ||||||||
| Онтология генов | AmiGO / QuickGO | ||||||||
| |||||||||
| UDP-галактозо-4-эпимераза | |
|---|---|
 GALE человека, связанный с NAD + и UDP-GlcNAc, с выделенными N- и C-концевыми доменами. Asn 207 не позволяет разместить UDP-GlcNAc в активном сайте. GALE человека, связанный с NAD + и UDP-GlcNAc, с выделенными N- и C-концевыми доменами. Asn 207 не позволяет разместить UDP-GlcNAc в активном сайте. | |
| Идентификаторы | |
| Символ | GALE |
| Ген NCBI | 2582 |
| HGNC | 4116 |
| OMIM | 606953 |
| RefSeq | NM_000403 |
| UniProt | Q14376 |
| Другие данные | |
| Номер EC | 5.1.3.2 |
| Locus | Chr. 1 p36-p35 |
| НАД-зависимая эпимераза / дегидратаза | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| Идентификаторы | |||||||||
| Символ | ? | ||||||||
| Pfam | PF01370 | ||||||||
| InterPro | IPR001509 | ||||||||
| Мембранома | 330 | ||||||||
| |||||||||
фермент UDP-глюкозо-4-эпимераза (EC 5.1.3.2 ), также известный как UDP-галактозо-4-эпимераза или GALE представляет собой гомодимерную эпимеразу, обнаруженную в клетках бактерий, грибов, растений и млекопитающих. Этот фермент выполняет последнюю стадию пути Лелуара метаболизма галактозы, катализируя обратимое превращение UDP-галактозы в UDP-глюкозу.. GALE прочно связывает никотинамидадениндинуклеотид (NAD +), кофактор, необходимый для каталитической активности.
Кроме того, человеческие и некоторые бактериальные изоформы GALE обратимо катализируют образование UDP-N-ацетилгалактозамина ( UDP-GalNAc) из UDP-N-ацетилглюкозамина (UDP-GlcNAc ) в присутствии NAD +, начальная стадия синтеза гликопротеина или гликолипида.
Др. Луис Лелуар вывел роль GALE в метаболизме галактозы во время своего пребывания в Институте биохимических исследований фонда Campomar, первоначально назвав фермент вальденазой. Д-р Лелуар был удостоен Нобелевской премии по химии 1970 года за открытие сахарных нуклеотидов и их роли в биосинтезе углеводов.
GALE относится к коротким суперсемейство белков -цепочечной дегидрогеназы / редуктазы (SDR). Это семейство характеризуется консервативным мотивом Tyr-X-X-X-Lys, необходимым для ферментативной активности; одна или несколько складок Россманна ; и способность связывать NAD.
Структура GALE была определена для ряда видов, включая E. coli и люди. GALE существует в виде гомодимера у разных видов.
Хотя размер субъединицы варьируется от 68 аминокислот (Enterococcus faecalis) до 564 аминокислот (Rhodococcus jostii), большинство субъединиц GALE кластер длиной около 330 аминокислот. Каждая субъединица содержит два отдельных домена. N-концевой домен содержит 7-мицепочечный параллельный β-складчатый лист, фланкированный α-спиралями. Парные складки Россмана в этом домене позволяют GALE прочно связывать один кофактор NAD на субъединицу. 6-нитевой β-лист и 5 α-спиралей составляют C-концевой домен GALE. С-концевые остатки связывают UDP, так что субъединица отвечает за правильное позиционирование UDP-глюкозы или UDP-галактозы для катализа.
Зазор между N- и C-концом GALE домены составляют активный сайт фермента. Консервативный мотив Tyr-X-X-X Lys необходим для каталитической активности GALE; у человека этот мотив представлен Tyr 157-Gly-Lys-Ser-Lys 161, в то время как E. coli GALE содержит Tyr 149-Gly-Lys-Ser-Lys 153. Размер и форма активного сайта GALE варьируется в зависимости от вида, с учетом переменной субстратной специфичности GALE. Кроме того, конформация активного сайта внутри видоспецифичного GALE податлива; например, объемная N-ацетильная группа UDP-GlcNAc 2 'размещается в активном сайте GALE человека за счет вращения боковой цепи карбоксамида Asn 207.
| Остаток | Функция |
|---|---|
| Ala 216, Phe 218 | Якорное кольцо урацила на ферменте. |
| Asp 295 | Взаимодействует с 2'-гидроксильной группой рибозы. |
| Asn 179, Arg 231, Arg 292 | Взаимодействуют с фосфатными группами UDP. |
| Tyr 299, Asn 179 | Взаимодействовать с 2'-гидроксильной группой галактозы или 6'-гидроксильной группой глюкозы; правильно расположите сахар в активном участке. |
| Tyr 177, Phe 178 | Взаимодействовать с 3 'гидроксильной группой галактозы или 6' гидроксильной группой глюкозы; правильно расположите сахар в активном участке. |
| Lys 153 | Понижает pKa Tyr 149, позволяет отщеплять или отдавать атом водорода в 4'-гидроксильную группу сахара или от нее. |
| Tyr 149 | Абстрагирует или передает атом водорода в 4'-гидроксильную группу сахара или от нее, катализируя образование промежуточного соединения 4-кетопиранозы. |
GALE инвертирует конфигурацию 4'-гидроксильной группы UDP-галактозы через серию из 4 этапов. При связывании UDP-галактозы консервативный остаток тирозина в активном центре отрывает протон от 4'-гидроксильной группы.
Одновременно с этим 4'-гидрид добавляется к si-стороне NAD +, образуя NADH и Промежуточный 4-кетопираноза. Промежуточное соединение 4-кетопиранозы поворачивается на 180 ° вокруг пирофосфорильной связи между гликозильным кислородом и атомом β-фосфора, представляя собой противоположную сторону промежуточного соединения кетопиранозы по отношению к НАДН. Перенос гидрида от НАДН к этой противоположной поверхности инвертирует стереохимию 4 'центра. Затем консервативный остаток тирозина отдает свой протон, регенерируя 4'-гидроксильную группу.
Человеческие и некоторые бактериальные изоформы GALE обратимо катализируют превращение UDP- GlcNAc превращается в UDP-GalNAc через идентичный механизм, инвертируя стереохимическую конфигурацию 4'-гидроксильной группы сахара.
 Промежуточные звенья и ферменты в пути Лелуара метаболизма галактозы.
Промежуточные звенья и ферменты в пути Лелуара метаболизма галактозы. Для метаболизма галактозы не существует прямых катаболических путей. Таким образом, галактоза предпочтительно превращается в глюкозо-1-фосфат, который может шунтироваться в гликолиз или в путь синтеза инозита.
Функции GALE в качестве одного из четырех ферментов пути Лелуара превращения галактозы в глюкозо-1-фосфат. Во-первых, галактозамутаротаза превращает β-D-галактозу в α-D-галактозу. Галактокиназа затем фосфорилирует -D-галактозу по 1'-гидроксильной группе, давая галактозо-1-фосфат. На третьей стадии галактозо-1-фосфатуридилтрансфераза катализирует обратимый перенос фрагмента UMP от UDP-глюкозы в галактозо-1-фосфат, образуя UDP-галактозу и глюкозо-1-фосфат. На последнем этапе Leloir UDP-глюкоза регенерируется из UDP-галактозы посредством GALE; UDP-глюкоза возвращается к третьему этапу пути. Таким образом, GALE регенерирует субстрат, необходимый для продолжения цикла Лелуара.
Глюкозо-1-фосфат, образующийся на стадии 3 пути Лелуара, может быть изомеризован в глюкозо-6-фосфат с помощью фосфоглюкомутазы. Глюкозо-6-фосфат легко вступает в процесс гликолиза, что приводит к образованию АТФ и пирувата. Кроме того, глюкозо-6-фосфат может быть превращен в инозитол-1-фосфат с помощью инозитол-3-фосфатсинтазы, образуя предшественник, необходимый для биосинтеза инозита.
Человеческие и выбранные бактериальные изоформы GALE связывают UDP-GlcNAc, обратимо катализируя его превращение в UDP-GalNAc. Семейство гликозилтрансфераз, известных как UDP-N-ацетилгалактозамин: полипептидные N-ацетилгалактозаминтрансферазы (ppGaNTases), переносят GalNAc от UDP-GalNAc к остаткам гликопротеина серина и треонина. Гликозилирование, опосредованное ppGaNTase, регулирует сортировку белков, передачу сигналов лиганда, устойчивость к протеолитической атаке и представляет собой первый обязательный этап биосинтеза муцина.
Дефицит или дисфункция GALE человека приводит к типу III галактоземия, которая может существовать в легкой (периферической) или более тяжелой (генерализованной) форме.