 2D-гели (окрашенные кумасси)
2D-гели (окрашенные кумасси)  Роботы используются для выделения белковых пятен из 2D-гелей в современных лабораториях.
Роботы используются для выделения белковых пятен из 2D-гелей в современных лабораториях. Двумерный гель-электрофорез, сокращенно 2-DE или 2-D-электрофорез, представляет собой форму гель-электрофореза, обычно используемую для анализа белков. Смеси белков разделены двумя свойствами в двух измерениях на 2D-гелях. 2-DE был впервые независимо введен О'Фарреллом и Клозе в 1975 году.
2-Д - электрофорез начинается с электрофорезом в первом измерении, а затем отделяет молекулы перпендикулярно от первой, чтобы создать electropherogram во втором измерении. При электрофорезе в первом измерении молекулы разделяются линейно в соответствии с их изоэлектрической точкой. Во втором измерении молекулы затем разделяются под углом 90 градусов от первой электрофореграммы в соответствии с молекулярной массой. Поскольку маловероятно, что две молекулы будут похожи по двум различным свойствам, молекулы более эффективно разделяются при 2-мерном электрофорезе, чем при 1-мерном электрофорезе.
Двумя измерениями, на которые разделяются белки с помощью этого метода, могут быть изоэлектрическая точка, масса белкового комплекса в нативном состоянии или масса белка.
Разделение белков по изоэлектрической точке называется изоэлектрическим фокусированием (IEF). Таким образом, к гелю применяется градиент pH, и электрический потенциал прикладывается к гелю, делая один конец более положительным, чем другой. При всех значениях pH, кроме их изоэлектрической точки, белки будут заряжаться. Если они заряжены положительно, они будут притягиваться к более отрицательному концу геля, а если они заряжены отрицательно, они будут притянуты к более положительному концу геля. Белки, нанесенные в первом измерении, будут двигаться по гелю и накапливаться в своей изоэлектрической точке; то есть точка, в которой общий заряд белка равен 0 (нейтральный заряд).
Для анализа функционирования белков в клетке важно знание их взаимодействия. Чаще всего белки действуют вместе в комплексах, чтобы быть полностью функциональными. Анализ этой суборганической организации клетки требует методов, сохраняющих естественное состояние белковых комплексов. При электрофорезе в нативном полиакриламидном геле ( нативный PAGE ) белки остаются в своем нативном состоянии и разделяются в электрическом поле в соответствии с их массой и массой их комплексов соответственно. Чтобы получить разделение по размеру, а не по чистому заряду, как в IEF, дополнительный заряд переносится на белки с помощью кумасси бриллиантового синего или додецилсульфата лития. После завершения первого измерения комплексы разрушаются путем применения денатурирующего SDS-PAGE во втором измерении, где белки, из которых состоят комплексы, разделяются по своей массе.
Перед разделением белков по массе их обрабатывают додецилсульфатом натрия (SDS) вместе с другими реагентами ( SDS-PAGE в 1-D). Это денатурирует белки (то есть разворачивает их в длинные прямые молекулы) и связывает ряд молекул SDS, примерно пропорциональных длине белка. Поскольку длина белка (в развернутом виде) примерно пропорциональна его массе, это равносильно утверждению, что он присоединяет количество молекул SDS, примерно пропорциональное массе белка. Поскольку молекулы SDS заряжены отрицательно, в результате все белки будут иметь примерно одинаковое отношение массы к заряду друг у друга. Кроме того, белки не будут мигрировать, когда они не имеют заряда (в результате этапа изоэлектрической фокусировки), поэтому покрытие белка в SDS (отрицательно заряженном) позволяет переносить белки во втором измерении (SDS-PAGE, это не совместимы для использования в первом измерении, поскольку он заряжен, и необходимо использовать неионогенное или цвиттерионное моющее средство). Во втором измерении снова прикладывается электрический потенциал, но под углом 90 градусов к первому полю. Белки будут притягиваться к более положительной стороне геля (потому что SDS заряжен отрицательно) пропорционально их соотношению массы к заряду. Как объяснялось ранее, это соотношение будет почти одинаковым для всех белков. Продвижение белков будет замедляться силами трения. Таким образом, гель действует как молекулярное сито при приложении тока, разделяя белки на основе их молекулярной массы, при этом более крупные белки удерживаются выше в геле, а более мелкие белки могут проходить через сито и достигать нижних областей геля..
В результате получается гель с распределенными по его поверхности белками. Затем эти белки можно обнаружить различными способами, но чаще всего используются окраски серебром и кумасси бриллиантовым синим. В первом случае на гель наносится коллоид серебра. Серебро связывается с цистеиновыми группами в белке. Серебро темнеет под воздействием ультрафиолетового света. Количество серебра может быть связано с темнотой и, следовательно, с количеством белка в данном месте геля. Это измерение может дать только приблизительные суммы, но подходит для большинства целей. Окрашивание серебром в 100 раз более чувствительно, чем кумасси бриллиантовый синий, с 40-кратным диапазоном линейности.
Молекулы, отличные от белков, можно разделить с помощью 2D-электрофореза. В анализах суперспирализации спиральная ДНК разделяется в первом измерении и денатурируется интеркалятором ДНК (таким как бромид этидия или менее канцерогенный хлорохин ) во втором. Это сопоставимо с комбинацией нативного PAGE / SDS-PAGE при разделении белков.
Распространенным методом является использование иммобилизованного градиента pH (IPG) в первом измерении. Этот метод называется IPG-DALT. Образец сначала разделяют на гель IPG (который имеется в продаже), затем гель разрезают на срезы для каждого образца, который затем уравновешивают в SDS-меркаптоэтаноле и наносят на гель SDS-PAGE для разрешения во втором измерении. Обычно IPG-DALT не используется для количественного определения белков из-за потери низкомолекулярных компонентов во время переноса на гель SDS-PAGE.
См. Изоэлектрическую фокусировку
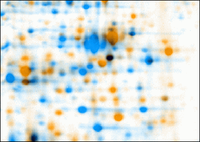 Деформация: изображения двух 2D-гелей для электрофореза, наложенные Delta2D. Первое изображение окрашено в оранжевый цвет, второе - в синий. Из-за различий хода соответствующие точки не перекрываются.
Деформация: изображения двух 2D-гелей для электрофореза, наложенные Delta2D. Первое изображение окрашено в оранжевый цвет, второе - в синий. Из-за различий хода соответствующие точки не перекрываются.  Деформация: изображения двух двухмерных гелей для электрофореза после деформации. Первое изображение окрашено в оранжевый цвет, второе - в синий. Соответствующие пятна перекрываются после коробления. Обычные пятна окрашены в черный цвет, оранжевые пятна присутствуют (или намного сильнее) только на первом изображении, синие пятна присутствуют (или намного сильнее) на втором изображении.
Деформация: изображения двух двухмерных гелей для электрофореза после деформации. Первое изображение окрашено в оранжевый цвет, второе - в синий. Соответствующие пятна перекрываются после коробления. Обычные пятна окрашены в черный цвет, оранжевые пятна присутствуют (или намного сильнее) только на первом изображении, синие пятна присутствуют (или намного сильнее) на втором изображении. В количественной протеомике эти инструменты в первую очередь анализируют биомаркеры, количественно оценивая отдельные белки и показывая разделение между одним или несколькими белковыми «пятнами» на отсканированном изображении геля 2-DE. Кроме того, эти инструменты сопоставляют пятна между гелями схожих образцов, чтобы показать, например, протеомные различия между ранней и поздней стадиями заболевания. Пакеты программного обеспечения включают, среди прочего, Delta2D, ImageMaster, Melanie, PDQuest, Progenesis и REDFIN. Хотя эта технология широко используется, интеллект еще не доведен до совершенства. Например, хотя PDQuest и Progenesis имеют тенденцию согласовывать количественную оценку и анализ четко определенных четко разделенных белковых пятен, они дают разные результаты и тенденции анализа с менее выраженными, менее разделенными пятнами.
Проблемы автоматического программного анализа включают не полностью разделенные (перекрывающиеся) пятна (менее определенные и / или разделенные), слабые места / шум (например, «пятна-призраки»), различия между гелями (например, белок мигрирует в разные положения на различные гели), несогласованные / необнаруженные пятна, приводящие к отсутствующим значениям, несовпадающим точкам, ошибкам в количественной оценке (несколько отдельных точек могут быть ошибочно обнаружены программным обеспечением как одно пятно и / или части пятна могут быть исключены из количественной оценки), и различия в алгоритмах программного обеспечения и, следовательно, тенденции анализа
Сгенерированные списки выбора можно использовать для автоматизированного переваривания белковых пятен в геле и последующей идентификации белков с помощью масс-спектрометрии. Масс-спектрометрический анализ может идентифицировать точные измерения массы наряду с секвенированием пептидов в диапазоне от 1000 до 4000 атомных единиц массы. Для обзора текущего подхода к программному анализу изображений гелей 2DE см. Или.
| Ресурсы библиотеки о двумерном гель-электрофорезе |