Аналоги переходного состояния (аналоги переходного состояния ), это химические соединения с химической структурой, которое напоминает переходное состояние молекулы субстрата в ферменте -катализируемая химическая реакция. Ферменты взаимодействуют с субстратом посредством деформации или искажений, перемещая субстрат в переходное состояние. Аналоги переходного состояния можно использовать в качестве ингибиторов в реакциях, катализируемых ферментами, путем блокирования активного центра фермента. Теория предполагает, что ингибиторы фермента, которые напоминают структуру переходного состояния, будут более прочно связываться с ферментом, чем реальный субстрат. Примеры препаратов, которые являются аналоговыми ингибиторами переходного состояния, включают препараты от гриппа, такие как ингибитор нейраминидазы озельтамивир и ингибиторы протеазы ВИЧ саквинавир в лечении СПИДа.

переходное состояние структуры лучше всего можно описать с точки зрения статистическая механика, в которой энергии разрыва и образования связей имеют равную вероятность перехода из переходного состояния назад к реагентам или вперед к продуктам. В реакциях, катализируемых ферментами, общая энергия активации реакции снижается, когда фермент стабилизирует высокоэнергетический промежуточный продукт переходного состояния. Аналоги переходного состояния имитируют это промежуточное соединение с высокой энергией, но не подвергаются катализируемой химической реакции и поэтому могут гораздо сильнее связываться с ферментом, чем простые аналоги субстрата или продукта.
Основным этапом разработки аналога переходного состояния является определение структуры переходного состояния субстрата на конкретном интересующем ферменте экспериментальным методом, например, кинетический изотопный эффект. Кроме того, структура переходного состояния также может быть предсказана с помощью вычислительных подходов в качестве дополнения к KIE. Мы кратко объясним эти два метода.
Кинетический изотопный эффект (KIE) - это измерение скорости реакции реагентов, меченных изотопом, с более распространенным природным субстратом. Значения кинетического изотопного эффекта представляют собой отношение числа оборотов и включают все стадии реакции. Значения собственных кинетических изотопов проистекают из разницы в колебательном окружении связи атома в реагентах в основном состоянии с окружением переходного состояния атома. Благодаря кинетическому изотопному эффекту можно получить много сведений о том, как выглядит переходное состояние в реакции, катализируемой ферментами, и направить разработку аналогов переходного состояния.
Вычислительные подходы рассматриваются как полезный инструмент для выяснения механизма действия ферментов. Молекулярная механика сама по себе не может предсказать перенос электронов, который является основой органической реакции, но моделирование молекулярной динамики дает достаточно информации, учитывающей гибкость белка во время каталитической реакции. Дополнительным методом может быть сочетание методов молекулярной механики / квантовой механики (QM / MM ). При таком подходе только атомы, ответственные за ферментативную реакцию в каталитической области, будут выращены с помощью квантовой механики, а остальные атомы будут обработаны с помощью молекулярной механики.
После определения структур переходного состояния с использованием KIE или вычислительного моделирования, ингибитор может быть разработан в соответствии с определенными структурами переходного состояния или промежуточными продуктами. Следующие три примера показывают, как ингибиторы имитируют структуру переходного состояния, изменяя функциональные группы, соответствующие геометрии и электростатическому распределению структур переходного состояния.
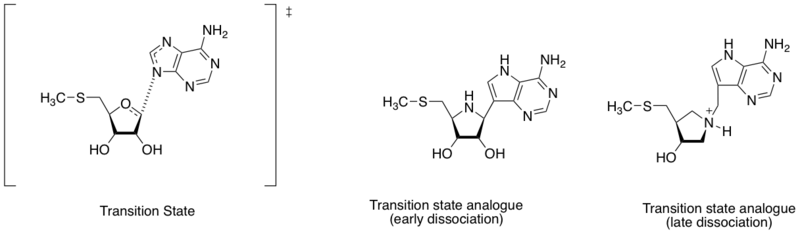
Метилтиоаденозинуклеозидаза - это ферменты, которые катализируют реакцию гидролитического деаденилирования 5'-метилтиоаденозина и S-аденозилгомоцистеина. Он также считается важной целью для открытия антибактериальных лекарств, поскольку он важен для метаболической системы бактерий и продуцируется только бактериями. Учитывая различное расстояние между атомом азота аденина и аномерным углеродом рибозы (см. Диаграмму в этом разделе), структура переходного состояния может определяться ранней или поздней стадией диссоциации. Основываясь на обнаружении различных структур переходных состояний, Шрамм и его коллеги разработали два аналога переходного состояния, имитирующие раннее и позднее диссоциативное переходное состояние. Аналог раннего и позднего переходного состояния показал сродство связывания (Kd), равное 360 и 140 пМ соответственно.

Термолизин представляет собой фермент, продуцируемый Bacillus thermoproteolyticus, который катализирует гидролиз пептидов, содержащих гидрофобные аминокислоты. Следовательно, он также является мишенью для антибактериальных средств. Механизм ферментативной реакции начинается с небольшой молекулы пептида и замещает молекулу воды, связывающую цинк, на Glu143 термолизина. Затем молекула воды активируется как ионом цинка, так и остатком Glu143 и атакует карбонильный углерод с образованием тетраэдрического переходного состояния (см. Рисунок). Затем Холден с соавторами воспроизвели это тетраэдрическое переходное состояние для создания серии аналогов фосфонамидатного пептида. Среди синтезированных аналогов R = L -Leu обладает наиболее сильной ингибирующей активностью (K i = 9,1 нМ).
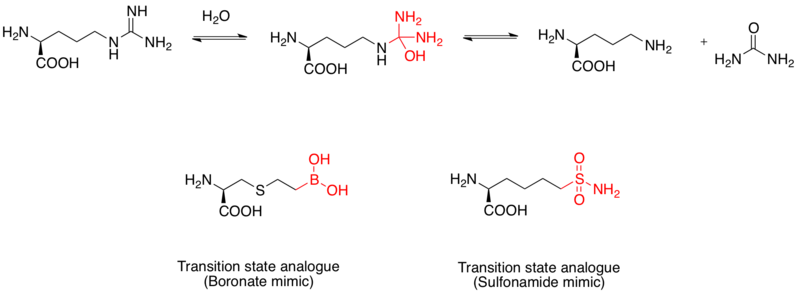
аргиназа представляет собой двухъядерный марганец металлопротеин, который катализирует гидролиз L- аргинина до L- орнитина и мочевины. Он также рассматривается как лекарственная мишень для лечения астмы. Механизм гидролиза L-аргинина осуществляется через нуклеофильную атаку воды на гуанидино-группу с образованием тетраэдрического промежуточного соединения. Исследования показали, что фрагмент бороновой кислоты принимает тетраэдрическую конфигурацию и служит ингибитором. Кроме того, функциональная группа сульфонамида также может имитировать структуру переходного состояния. Доказательства наличия имитаторов бороновой кислоты в качестве аналоговых ингибиторов аргиназы человека в переходном состоянии были выявлены с помощью рентгеновских кристаллических структур.