| ДНК-топоизомераза I, N-концевой (некаталитический), вирусный | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 амино-концевой домен 9kda ДНК-топоизомеразы вируса осповакцины i, остатки 1-77, экспериментальная электронная плотность для остатков 1-77 амино-концевой домен 9kda ДНК-топоизомеразы вируса осповакцины i, остатки 1-77, экспериментальная электронная плотность для остатков 1-77 | |||||||||
| Идентификаторы | |||||||||
| Условное обозначение | VirDNA-topo-I_N | ||||||||
| Pfam | PF09266 | ||||||||
| ИнтерПро | IPR015346 | ||||||||
| SCOP2 | 1vcc / SCOPe / SUPFAM | ||||||||
| |||||||||
В молекулярной биологии топоизомеразы типа I представляют собой ферменты, которые разрезают одну из двух цепей двухцепочечной ДНК, расслабляют цепь и повторно отжигают цепь. Далее они подразделяются на две структурно и механически отличные топоизомеразы: тип IA и тип IB.
Исторически топоизомеразы типа IA называют прокариотическим топо I, а топоизомеразы типа IB называют эукариотической топоизомеразой. Однако это различие больше не применяется, поскольку топоизомеразы типа IA и IB существуют во всех сферах жизни.
Функционально эти подклассы выполняют очень специализированные функции. Прокариотическая топоизомераза I (topo IA) может релаксировать только отрицательную суперспиральную ДНК, тогда как эукариотическая топоизомераза I (topo IB) может вводить положительные суперспирали, разделяя ДНК дочерних хромосом после репликации ДНК, и расслаблять ДНК.
Эти ферменты имеют несколько функций: удаление суперспиралей ДНК во время транскрипции и репликации ДНК ; на разрыв цепи при рекомбинации ; для конденсации хромосом ; и распутывать переплетенную ДНК во время митоза.
Этот домен предполагает укладку бета (2) -альфа-бета-альфа-бета (2) с левосторонним кроссовером между цепями бета2 и бета3. Он имеет четыре перекрещенных бета-нити, окруженных четырьмя альфа-спиралями, которые расположены в складке Россмана.
Топоизомеразы типа I являются АТФ- независимыми ферментами (за исключением обратной гиразы ) и могут быть подразделены в соответствии с их структурой и механизмами реакции: тип IA (бактериальная и архейная топоизомераза I, топоизомераза III и обратная гираза) и тип IB (эукариотическая топоизомераза I и топоизомераза V). Эти ферменты в первую очередь отвечают за расслабление положительно и / или отрицательно свернутой ДНК, за исключением обратной гиразы, которая может вводить положительные суперспирали в ДНК.
Топоизомеразы ДНК регулируют количество топологических связей между двумя нитями ДНК (т. Е. Изменяют количество суперспиральных витков), катализируя временные одно- или двухцепочечные разрывы, пересекая цепи друг с другом, а затем повторно закрывая разрывы.
ДНК-топоизомеразы делятся на два класса: ферменты типа I ( ЭК ; топоизомеразы I, III и V) разрушают одноцепочечную ДНК, а ферменты типа II ( ЭК ; топоизомеразы II, IV и VI) разрушают двухцепочечную ДНК.
 Структура topo III, связанного с одноцепочечной ДНК (pdb ID 1I7D). Обратите внимание, что ДНК похожа на ДНК B-формы.
Структура topo III, связанного с одноцепочечной ДНК (pdb ID 1I7D). Обратите внимание, что ДНК похожа на ДНК B-формы. Топоизомеразы типа IA, исторически считавшиеся обнаруженными у прокариот, создают единственный разрыв в ДНК и пропускают вторую цепь или дуплекс через разрыв. Этот механизм прохождения цепи имеет несколько общих черт с топоизомеразами типа IIA. Оба они образуют 5'-фосфотирозиновый промежуточный продукт, и для его работы требуется ион двухвалентного металла. В отличие от топоизомераз типа II, топоизомеразы типа IA не используют энергию для выполнения своей работы (за заметным исключением обратной гиразы, см. Ниже).
Топоизомеразы типа IA имеют несколько доменов, часто это домены 1-4. Домен I содержит домен Toprim (складка Россмана, которая, как известно, координирует ионы магния), домен IV и домен III, каждый из которых состоит из домена спираль-поворот-спираль (HTH); каталитический тирозин находится на HTH домена III. Домен II - это гибкий мост между доменами III и IV. Структура топоизомеразы типа IA напоминает замок с доменами I, III и IV, лежащими на дне структуры. Структура topo III (см. Ниже), связанная с одноцепочечной ДНК (pdb id = 1I7D), показывает, как HTH и домен Toprim скоординированы относительно ДНК.
Существует несколько вариантов топоизомераз типа IA, отличающихся отростками, прикрепленными к основному ядру (иногда их называют «топо-складкой»). Члены этого подкласса включают топо I, топо III (которые содержат дополнительные цинк-связывающие мотивы) и обратную гиразу. Обратная гираза особенно интересна, потому что присоединяется домен АТФазы, который напоминает геликазоподобный домен фактора транскрипции Rho (структура обратной гиразы была решена Rodriguez and Stock, EMBO J 2002). Фермент использует гидролиз АТФ для введения положительных суперспиралей и перекрывает ДНК, что является привлекательной особенностью гипертермофилов, в которых, как известно, существует обратная гираза. Родригес и Сток проделали дополнительную работу, чтобы идентифицировать «защелку», которая участвует в передаче гидролиза АТФ с введением положительных суперспиралей.
Вариант topo III также очень интересен, потому что он имеет цинк-связывающие мотивы, которые, как считается, связывают одноцепочечную ДНК. Было установлено, что Topo III связан с геликазой BLM (для синдрома Блума) во время рекомбинации.
Топоизомеразы типа IA действуют через механизм прохождения цепей с использованием единственного гейта (в отличие от топоизомераз типа II). Во-первых, одноцепочечная ДНК связывает домены III и I. Каталитический тирозин расщепляет основную цепь ДНК, создавая временное 5'-фосфотирозиновое промежуточное соединение. Затем разрыв разделяется с использованием домена II в качестве шарнира и пропускается второй дуплекс или цепь ДНК. Домены III и I закрываются, и ДНК повторно отжигается.
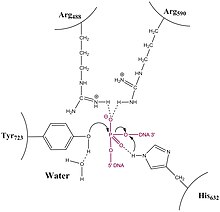 Важные остатки активного сайта топоизомеразы IB. ДНК окрашена в малиновый цвет.
Важные остатки активного сайта топоизомеразы IB. ДНК окрашена в малиновый цвет.  Активный сайт топоизомеразы IB. ДНК окрашена в малиновый цвет с голубым остовом. (ID PDB = 1A36)
Активный сайт топоизомеразы IB. ДНК окрашена в малиновый цвет с голубым остовом. (ID PDB = 1A36) В отличие от топоизомераз типа IA, топоизомераза типа 1B решает проблему перемотанной и перемотанной (также называемой положительно или отрицательно сверхспиральной) ДНК посредством механизма затрудненного вращения. Кристаллические структуры, биохимия и эксперименты с отдельными молекулами внесли свой вклад в общий механизм. Сначала фермент оборачивается вокруг ДНК и образует единственный промежуточный 3'-фосфотирозин. 5'-конец затем может свободно вращаться, скручивая его вокруг другой цепи, чтобы расслабить ДНК, пока топоизомераза не повторно лигирует разорванные цепи.
Структура topo IB, связанного с ДНК, была решена (pdb id = 1A36). Topo IB состоит из NTD, кэпирующей доли, каталитической доли и С-концевого домена. Покрывающая доля и каталитическая доля охватывают ДНК.
Расслабление не является активным процессом, и энергия (в форме АТФ ) не расходуется на этапах надкола или лигирования; это происходит потому, что реакция между остатком тирозина в активном центре фермента с фосфодиэфирным остовом ДНК просто заменяет одну фосфомоноэфирную связь на другую. Топоизомераза также не использует АТФ при раскручивании ДНК; скорее, крутящий момент, присутствующий в ДНК, вызывает раскручивание и в среднем энергично идет вниз. Недавние эксперименты с одной молекулой подтвердили то, что ранее предлагалось в экспериментах по релаксации объемной плазмиды, а именно, что раскручивание ДНК происходит под действием крутящего момента и продолжается до тех пор, пока не произойдет религия. Нет данных, свидетельствующих о том, что Topo IB «контролирует» поворот, поскольку у него есть механизм, который запускает религию после удаления определенного количества суперспиралей. Напротив, эксперименты с одной молекулой предполагают, что лигирование является случайным процессом и имеет некоторую вероятность происходить каждый раз, когда поворотный 5'-ОН-конец оказывается в непосредственной близости от сайта связывания ферментно-связанного 3'-конца.
Топоизомеразы типа IB были первоначально идентифицированы у эукариот и вирусов. Вирусный topo I уникален, потому что он связывает ДНК специфическим для последовательности образом.
См. Статью TOP1 для получения дополнительных сведений об этой хорошо изученной топоизомеразе типа 1B.
Третий тип топоизомеразы I, topo V, был идентифицирован у архея Methanopyrus kandleri. Topo V является членом-основателем и пока единственным членом топоизомеразы типа IC, хотя некоторые авторы предполагают, что она может иметь вирусное происхождение. Решена кристаллическая структура topo V. Топоизомеразы типа IC действуют посредством контролируемого вращательного механизма, во многом как топоизомеразы типа IB (pdb ID = 2CSB и 2CSD ), но складка уникальна.
Все топоизомеразы образуют фосфотирозиновый промежуточный продукт между каталитическим тирозином фермента и подвижным фосфорилом основной цепи ДНК.
Этот промежуточный продукт является изоэнергетическим, что означает, что прямая реакция расщепления и обратная реакция религирования энергетически равны. Таким образом, для проведения этой реакции не требуется никакого внешнего источника энергии.
Поскольку топоизомеразы создают разрывы в ДНК, они являются мишенями низкомолекулярных ингибиторов, которые ингибируют фермент. Топоизомераза 1 типа ингибируется иринотеканом, топотеканом, гексилрезорцином и камптотецином.
Фермент топоизомераза типа IB человека образует ковалентный промежуточный 3'-фосфотирозин, комплекс расщепления топоизомеразы 1 (Top1cc). Активный иринотекана метаболита, SN-38, действует путем захвата (делая тройной комплекс с) подмножество Top1cc, те, с гуанина +1 в последовательности ДНК. Одна производная иринотекана молекула SN-38 складывается против пар оснований, фланкирующих сайт расщепления, вызванного топоизомеразой, и отравляет (инактивирует) фермент топоизомеразу 1.
После инфицирования бактериофагом (фагом) T4 его бактериального хозяина, Escherichia coli, геном фага определяет продукт гена (gp55.2), который ингибирует бактериальную топоизомеразу I. Gp55.2 связывает ДНК и специфически блокирует релаксацию отрицательно свернутой ДНК топоизомеразой. I. Это ингибирование, по-видимому, является адаптацией для тонкой модуляции активности топоизомеразы I хозяина во время инфекции для обеспечения оптимального выхода фага.
Синтетическая летальность возникает, когда комбинация недостатков экспрессии двух или более генов приводит к гибели клеток, тогда как недостаток только одного из этих генов этого не делает. Недостатки могут возникать в результате мутации, эпигенетических изменений или ингибирования экспрессии гена.
Ингибирование топоизомеразы 1 является синтетическим летальным исходом при недостаточной экспрессии определенных генов репарации ДНК. У пациентов-людей гены репарации недостаточной ДНК включают WRN и MRE11. В доклинических исследованиях, связанных с раком, дефектные гены репарации ДНК включают ATM и NDRG1.
Аутоантитела направлены против типа I. топоизомеразы называются анти-SCL-70 антитело, названным по ассоциации с SCL eroderma и 70 кД, экстрагируемые иммунореактивный фрагмент, который может быть получен из ( в противном случае большего 100-105 кДа) целевая топоизомераза антигена ( так называемого SCL -70 Antigen) антител.