 Упрощенный обзор общих методов, используемых в регенеративной медицине
Упрощенный обзор общих методов, используемых в регенеративной медицине Тканевая инженерия - это использование комбинации клетки, инженерия и материалы методы, а также подходящие биохимические и физико-химические факторы для улучшения или замены биологических тканей. Тканевая инженерия включает <использование тканевого каркаса для нового образования жизнеспособной ткани в медицинских целях. Когда-то он был отнесен к подполе биоматериалов, но, увеличившись по объему и значению, может рассматриваться как отдельная область.
 Воспроизвести медиа Что такое тканевая инженерия и как она работает
Воспроизвести медиа Что такое тканевая инженерия и как она работает Большой спектр приложений, которые восстанавливают или заменяют части или целые ткани (например, кость, хрящ, кровеносные сосуды, мочевой пузырь, кожа, мышца и т. д.). Часто задействованным тканям для правильного функционирования требуются механические и структурные свойства. Этот термин также применяется к усилиям по выполнению определенных биохимических функций с клетками в рамках искусственно созданной системы поддержки (например, искусственно поджелудочная железа или биоискусственная печень ). Термин регенеративная медицина часто используется как синоним тканевой инженерии, хотя те, кто занимается регенеративной медициной, уделяют больше внимания использованию стволовых клеток или предшественников. клетки для производства тканей.
 Микромассовые культуры клеток C3H-10T1 / 2 при различном давлении кислорода, окрашенные альциановым синимом
Микромассовые культуры клеток C3H-10T1 / 2 при различном давлении кислорода, окрашенные альциановым синимом Обычно применяемое определение тканевой Как указано, как указано Лангером и Vacanti, это «междисциплинарная область, применяет принципы инженерии и науки о жизни для разработки биологических заменителей, которые восстанавливают, используя функцию или улучшают [Биологические ткани] Тканевая инженерия также определяет как «понимание принципов роста тканей и их применение для производства функциональной другой ткани для клинического использования». успеха в разработке терапевтических стратегий, направленных на замену, восстановление, поддержание или улучшение функции ткани ».
Мощные р азработки в междисциплинарной области тканевой инженерии привели к созданию нового набора частей для замены тканей и стратегий их реализации. Научные достижения в области биоматериалов, стволовых клеток, факторов роста и дифференцировки, а также биомиметических сред созданы уникальные возможности для изготовления тканей в лаборатории из комбинаций внеклеточных матриц. («Каркасы»), клетки и биологически активные молекулы. Среди основных проблем, стоящих сейчас перед тканевой инженерией, - необходимость в более сложной функциональности, а также в функциональной и биомеханической стабильности и васкуляризации выращенных в лаборатории тканях, предназначенных для трансплантации. Непрерывный успех тканевой инженерии и, в конечном итоге, разработка настоящих запасных частей для человека будет происходить в результате конвергенции инженерных и фундаментальных исследований в области тканей, матрицы, фактора роста, стволовых клеток и биологии развития, а также материаловедения и биоинформатики.
В 2003 году NSF опубликовал отчет, озаглавленный «Появление тканевой инженерии как области исследований», в котором дается подробное описание истории этой области.
Историческое происхождение термина неясно, определение изменилось за последние десятилетия. Термин впервые появился в публикации 1984 года, в которой описывалась организация эндотелиоподобной мембраны на поверхности давно имплантированного синтетического офтальмологического протеза
Первое современное использование термина как Признанный сегодня был в 1985 году исследователем, физиологом и биоинженером YC Fung из Центра инженерных исследований. Он использует объединить термины ткань (в фундаментальных отношениях между клетками и тканями) и инженерия (в отношении области модификации тканей). Этот официально был принят в 1987 году.
Человеческие ткани были предметом научного любопытства и исследования в течение тысяч лет.
В Древнем Египте врачи изучали трупы и живых людей, чтобы понять, как лечить раны. Они пересадили кожу с трупов на живых людей. Мумии также были изучены, чтобы понять различные методы лечения. Операции обычно выполнялись без каких-либо предварительных исследований о стерилизации, иммунологических ответах или кожных реакциях.
Между 1069 и 664 годами до наших эры признаков кожных трансплантатов и трансплантатов наблюдались на мумии и трупы состоятельных людей. Рядом с древним городом Фивы была обнаружена женщина от 50 до 60 лет с видимым протезом. Протез пальца ноги, скорее всего, был установлен из-за предыдущей борьбы с диабетом и выставлен в Каирском музее.
Между I и II веками нашей эры галло-римляне разработали имплантаты из кованого железа в некрополе в Шантамбре.
В 1931 году несколько признаков зубных имплантатов были обнаружены в челюсти, принадлежавшей женщине майя, датируемой 600 годом нашей эры. Это самое раннее свидетельство предшествующей формы тканевой инженерии в Америке.
Льняные нити были впервые разработаны ранними египтянами, а металлические и золотые нити были изобретены еще в 200 году эры. Современные свинцовые провода были изобретены в 1800 году, более безопасные и дешевые провода - в 1850 серебряном году.
Исследователи изучали иммунологические основы отказа от кожных аллотрансплантатов к первым десятилетиям 20-го века, но не было достигнуто значительного прогресса в каком-либо практическом решении. Заметный рост числа жертв ожогов после Второй мировой войны, для которых кожный аллотрансплантат был невозможен, дало новый импульс для исследований по замене кожи. В этот период иммунолог Питер Медавар внес свой вклад в дальнейший прогресс в понимании иммунологии отторжения трансплантата.
В начале 20 века ученые времени от времени экспериментировали с трансплантацией почки, но попытки организовать трансплантацию почки начались только в конце 1940-х годов. Колфф изобрел первую диализную систему в Нидерландах в годы войны; его архитектура была улучшена в больнице Питера Бента Бригама в Бостоне и впервые пациентами в 1948 году. Доступность краткосрочного диализа, кроме того, способствовала прогрессу в трансплантации, в результате чего Мюррей и его коллеги из Бригама и женской больницы успешноадили донорский почка от близнеца в 1954 году. Более поздние разработки иммуносупрессии для трансплантации, а также дальнейшее развитие системы диализа Колффа сделали оба метода пригодными для широкого, ежедневного использования, трансформирующего терминальную стадию почек. управление болезнями. Более точно имитировала бы функциональные роли почек и, таким образом, как ониратила бы деструктивные симптомы хронического диализа, более точно имитировала функциональные роли почек и, таким образом, как ониратила бы деструктивные симптомы хронического диализа. 5>
Старзл выполнил первую эффективную трансплантацию печени в 1967 году, но из-за наличия достаточного количества трансплантируемых органов исследователи и клиницисты продолжали искать альтернативные подходы к печеночной замена функций. Гемодиализ, гемоперфузия с использованием древесного угля или смол, или выведенные из строя ферменты элементы, плазмаферез и плафзмарез все еще не являются биологическими подходами, которые были изучены.
 Регенерация уха человека с использованием каркаса
Регенерация уха человека с использованием каркаса  окрашенные клетки в культуре
окрашенные клетки в культуре тканевая инженерия использует живые клетки в качестве инженерии материалы. Примеры использования живых фибробластов в замене или ремонте кожи, хрящ, восстановленных живыми хондроцитами, или другими типами клеток, другими способами..
Клетки стали доступны в качестве инженерных материалов, когда ученые из Geron Corp. в 1998 году появились, как увеличивать теломеры, создавая иммортализованные клеточные линии. До этого лабораторные культуры здоровых, доброкачественных клеток млекопитающих делятся только фиксированное число раз, до предела Хейфлика, прежде чем умирать.
Из жидких тканей, таких как кровь, клетки экстрагируют массовыми методами, обычно центрифугированием или аферезом. Из твердых тканей извлечение затруднено. Обычно ткань измельчают, а затем переваривают с помощью ферментов трипсина или коллагеназы для удаления внеклеточного матрикса (ECM), удерживающего клетки. После этого клетки свободно плавают и экстрагируются с помощью центрифугирования или афереза .. Переваривание трипсином очень зависит от температуры. Более высокие температуры переваривают матрицу быстрее, но наносят больший ущерб. Коллагеназа зависима от температуры и повреждает меньше клеток, но требует больше времени.
 Мыши эмбриональные стволовые клетки
Мыши эмбриональные стволовые клетки Клетки часто классифицируют по их источнику.
Аутологичные клетки получены от того же человека, которым они снова будут имплантированы. У аутологичных клеток меньше всего проблем с отторжением и передачей патогенов, однако в некоторых случаях они могут быть недоступны. Например, при генетического заболевания подходящие аутологичные клетки отсутствуют. Кроме того, очень больные или пожилые люди, а также пациенты, страдающие тяжелыми ожогами, не имеют достаточного количества аутологичных клеток для создания полезных клеточных линий. Более того, эти клетки нуждаются в некоторых хирургических операциях, связанных с необходимостью выполнения таких хирургических операций, которые приводят к инфекции донорского участка или хронической боли. Аутологические клетки также необходимо культивировать из образцов, прежде чем их можно будет использовать: это требует времени, поэтому аутологичные решения могут быть не очень быстрыми. В последнее время появилась тенденция к использованию мезенхимальных стволовых клеток из костного мозга и жира. Эти клетки могут дифференцироваться в различных типах тканей, включая кость, хрящ, жир и нерв. Большое количество клеток можно легко и быстро изолировать от жира, что открывает возможность быстрого и легкого использования большого количества клеток.
Аллогенные клетки происходят из тела донора того же вида. Хотя существуют некоторые этические ограничения использования человеческих клеток для исследований in vitro, использование дермальных фибробластов крайней плоти человека оказалось иммунологически безопасным и, следовательно, жизнеспособным выбором для тканевой инженерии кожи.
Ксеногенные клетки выделены из особей другого вида. В частности, клетки животных широко используются в экспериментах, направленных на создание сердечно-сосудистых имплантатов.
Сингенные или изогенные клетки выделяют из генетически идентичных организмов, таких как близнецы, клоны или высокоинбредные модели исследовательских животных.
Первичные клетки взяты из организма.
Вторичные ячейки из банка ячеек.
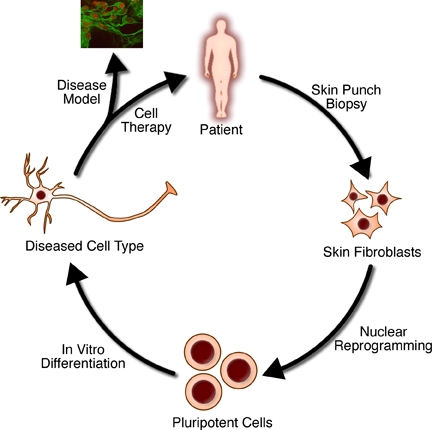
Стволовые клетки - это недифференцированные клетки, обладающие способностью делиться в культуре и давать начало различным формам клеток. По своему источнику стволовые клетки делятся на «взрослые» и «эмбриональные» стволовые клетки, первый класс - это мультипотентные, а второй - в основном плюрипотентные ; некоторые клетки тотипотентны на самых ранних стадиях эмбриона. Хотя до сих пор ведутся большие этические клетки, связанные с использованием эмбриональных стволовых клеток, источником которых считается другой альтернативный - индуцированные стволовые клетки могут быть полезен для восстановления больных или поврежденных тканей или может быть использован. вырастить новые органы.
Каркасы - это материалы, которые были разработаны, чтобы вызывать желательные клеточные взаимодействия, способствующие формированию новых функциональных тканей для медицинских целей. Клетки часто «засеваются» в эти структуры, способные поддерживать трехмерное формирование ткани. Каркасы имитируют клетчатку внеклеточный матрикс нативной ткани, воспроизводящую среду in vivo и позволяяя влиять на свое собственное микроокружение. Обычно они, удерживают жизненно важные питательные вещества и продукты экспрессии клеток, обеспечивают механические и биологические воздействия для изменения поведения клеточной фазы..
В 2009 году междисциплинарная группа под руководством торакального хирурга Торстена Уоллеса успешно имплантировала первый биоискусственный трансплантат, который обеспечивает врожденную сосудистую сеть для переноса трансплантата после трансплантации пациенту, ожидающего реконструкции трахеи.
 Эта анимация вращающейся углеродной нанотрубки показывает ее трехмерную устойчивость. Углеродные нанотрубки являются одними из примеров роли каркасов тканевой инженерии, поскольку они биосовместимы, устойчивы к биодеградации и могут быть функционализированы с помощью биомолекул. Однако возможность токсичности небиоразлагаемых наноматериалов до конца не изучена.
Эта анимация вращающейся углеродной нанотрубки показывает ее трехмерную устойчивость. Углеродные нанотрубки являются одними из примеров роли каркасов тканевой инженерии, поскольку они биосовместимы, устойчивы к биодеградации и могут быть функционализированы с помощью биомолекул. Однако возможность токсичности небиоразлагаемых наноматериалов до конца не изучена. Для достижения цели реконструкции тканей каркасы должны отвечать некоторым особым требованиям. Высокая пористость и адекватный размер пор необходимы для облегчения посева и диффузии клеток по всей структуре как клеток, так и питательных веществ. Биоразлагаемость часто является важным фактором, поскольку каркас предпочтительно должен абсорбироваться окружающими тканями без необходимости хирургического удаления. Скорость, с которой происходит деградация, должна максимально совпадать со скоростью образования ткани: это означает, что, пока клетки создают вокруг себя собственную естественную матричную структуру, каркас способен обеспечивать структурную целостность внутри тела, и в конечном итоге она будет разрушаются, оставляя вновь сформированную ткань, которая принимает на себя механическую нагрузку. Инъекции также важны для клинического использования. Недавние исследования печати органов показывают, насколько важен хороший контроль трехмерной среды для обеспечения воспроизводимости экспериментов и получения лучших результатов.
Было исследовано множество различных материалов (природных и синтетических, биоразлагаемых и прочных). Большинство из этих материалов были известны в области медицины еще до появления тканевой инженерии в качестве темы исследования и уже использовались в качестве биорассасывающихся шовных материалов. Примерами этих материалов являются коллаген и некоторые сложные полиэфиры.
. Были разработаны новые биоматериалы с идеальными свойствами и функциональной адаптацией: инъекция, синтетическое производство, биосовместимость, неиммуногенность., прозрачность, наноразмерные волокна, низкая концентрация, скорость резорбции и т. д. PuraMatrix, созданный в лабораториях Массачусетского технологического института в Чжан, Рича, Гродзинского и Лангера, является одним из этих новых семейств биомиметических каркасов, которые в настоящее время коммерциализированы.
Обычно используемым синтетическим материалом является PLA - полимолочная кислота. Это полиэфир, который разлагается в организме человека с образованием молочной кислоты, химического вещества природного происхождения, которое легко удаляется из организма. Аналогичными материалами являются полигликолевая кислота (PGA) и поликапролактон (PCL): их механизм разложения аналогичен механизму разложения PLA, но они демонстрируют соответственно более быструю и более медленную скорость разложения по сравнению с PLA. Хотя эти материалы хорошо сохраняют механическую прочность и структурную целостность, они обладают гидрофобной природой. Эта гидрофобность подавляет их биосовместимость, что делает их менее эффективными для использования in vivo в качестве каркаса тканей. Чтобы исправить отсутствие биосовместимости, было проведено много исследований по объединению этих гидрофобных материалов с гидрофильными и более биосовместимыми гидрогелями. Хотя эти гидрогели обладают превосходной биосовместимостью, им не хватает структурной целостности PLA, PCL и PGA. Комбинируя два разных типа материалов, исследователи пытаются создать синергетические отношения, которые создают более биосовместимые каркасы тканей. Каркасы также могут быть построены из природных материалов: в частности, были изучены различные производные внеклеточного матрикса, чтобы оценить их способность поддерживать рост клеток. Белковые материалы, такие как коллаген или фибрин, и полисахаридные материалы, такие как хитозан или гликозаминогликаны (ГАГ), все оказались подходящими с точки зрения совместимости с клетками, но некоторые проблемы с потенциальной иммуногенностью все еще остаются. Среди ГАГ гиалуроновая кислота, возможно, в комбинации со сшивающими агентами (например, глутаральдегид, водорастворимый карбодиимид и т. Д.), Является одним из источников вариантов в материал строительных лесов. Функционализированные группы каркасов могут быть полезны для доставки небольших молекул (лекарств) в край ткани. Другой исследуемого каркаса экстракты децеллюляризованных тканей, в которых оставшиеся клеточные остатки / внеклеточные матриксы как каркас. Недавно был изготовлен ряд нанокомпозитов биоматериалов путем включения наноматериалов в полимерную матрицу для создания биоактивных каркасов.
Исследование 2009 года, проведенное Derda et al. направлена на улучшение условий, подобных in vivo для трехмерной ткани путем "прокладки и разборки слоев бумаги, пропитанной суспензиями клеток в внеклеточном матриксе гидрогеле, что позволяет контролировать кислород и градиенты питательных веществ в 3D, а также для анализа молекулярных и генетических факторов ". Можно манипулировать градиентами растворимых молекул и охарактеризовать клетки в этих сложных градиентах более эффективно, чем традиционные 3D-культуры на основе гидрогелей, клеточных сфероидов или 3D-перфуз-реакторов. Бумага разной толщины и разные типы носителей подходят для различных экспериментальных сред. После деконструкции эти листы могут быть полезны при клеточном высокопроизводительном скрининге и открытии лекарств.
 тканевый сосудистый трансплантат
тканевый сосудистый трансплантат  тканевый инженерный клапан сердца
тканевый инженерный клапан сердца A В литературе описан ряд различных методов приготовления пористых структур для использования в качестве каркасов тканевой инженерии. Каждый из этих методов имеет свои преимущества, но ни один из них не лишенков.
Молекулярная самосборка - один из немногих методов создания биоматериалов со свойствами, аналогичными по степени и химическому составу естественного внеклеточному матриксу (ECM) in vivo, важный шаг к тканевой инженерии тканевых тканей. Более того, эти гидрогелевые каркасы показали превосходство в токсикологии и биосовместимости in vivo по сравнению с традиционными макрошкаффолдами и материалами животного происхождения.
Эти методы включают в себя все подходы, которые были успешно применены для изготовления нетканых сеток из различных полимеров. В частности, нетканые полигликолидные структуры были протестированы для использования в тканевой инженерии: обнаружено, что такие волокнистые структуры полезны для выращивания типов клеток. Основные недостатки связаны с трудом получения в высокой пористости и регулярного размера пор.
Литье растворителем и выщелачивание твердых частиц (SCPL) позволяет изготавливать структуру с постоянной пористостью, но с ограниченной толщиной. Сначала полимер растворяют в подходящем органическом растворителе (например, полимолочную кислоту можно растворить в дихлорметане ), раствор отливают в форму, заполненную частицами порообразующего вещества. Такой пороген может представлять собой неорганическую соль, как хлорид натрия, кристаллы сахарозы, желатиновые сферы или парафиновые сферы. Размер частиц порообразующего вещества будет влиять на размер порообразующего вещества, в то время как отношение полимера к порообразующему веществу напрямую коррелирует с величиной пористости конечной структуры. После заливки полимера растворителя дают полностью испариться, затем композитную структуру в форме в ванну с жидкостью, подходящей для раствора порогена: вода в хлориде натрия, сахароза и желатин или алифатический растворитель, такой как гексан, для использования с парафином. После полного растворения порогена получается пористая структура. Помимо всего диапазона толщин, который может быть получен, еще один недостаток SCPL заключается в использовании небольшого количества ошибок, которые необходимо удалить, чтобы избежать любого возможного повреждения клеток, засеянных на каркасе.
для использования технологии использования технологий использования твердых порогенов, используемой технологии использования газа в качестве порогена. Производятся дискообразные конструкции из желаемого полимера посредством формования под давлением с использованием нагретой формы. Затем диски помещают в камеру, где они подвергаются воздействию высокого давления CO2 в течение нескольких дней. Давление внутри камеры постепенно восстанавливается до атмосферного. Во время этой процедуры поры образуются молекулы углекислого газа, которые покидают полимер, в результате чего получается губчатая структура. Основные проблемы, возникающие в результате использования таких технологий, вызваны чрезмерным нагревом, используемым во время компрессионного формования (что запрещает включение термолабильного материала в полимерную матрицу), и тем фактом, что поры не образуют взаимосвязанную структуру.
Этот метод не требует такого использования твердого порогена, как SCPL. Первый синтетический полимер растворяют в подходящем растворителе (например, полимолочную кислоту в дихлорметане), затем к раствору полимера добавляют воду и две жидкости смешивают для эмульсии. Прежде чем две фазы способ разделиться, эмульсию отливают в форму и быстро замораживают посредством погружения в жидкий азот. Затем замороженную эмульсию лиофилизируют для удаления диспергированной воды и растворителя, в результате чего остается затвердевшая пористая полимерная структура. Хотя эмульгирование и сублимационная сушка позволяют проводить более быстрое приготовление по сравнению с SCPL (поскольку он не требует длительной стадии выщелачивания), он все же требует использования растворителей. Кроме того, размер пор относительно невелик, а пористость часто бывает неравномерной. Сама по себе сублимационная сушка также является широко применяемой техникой для изготовления каркасов. В частности, его используют для изготовления коллагеновых губок: коллаген растворяют в кислых растворах уксусной кислоты или соляной кислоты, которые заливают в форму, замораживают жидким азотом и лиофилизированный.
Подобно предыдущей методике, процедура разделения фаз TIPS требует использования растворителя с низкой температурой плавления, который легко сублимировать. Например, диоксан может быть использован для растворения полимолочной кислоты, тогда разделение фаз вызывается добавлением небольшого количества воды: образуется фаза с высоким уровнем полимера и фаза с низким уровнем полимера. После охлаждения ниже точки плавления растворителя и нескольких дней вакуумной сушки для возгонки растворителя получают пористую основу. Разделение жидкой и жидкой фаз имеет те же недостатки, что и эмульгирование / сублимационная сушка.
Электроформование - это очень универсальный метод, который можно использовать для производства непрерывных волокон от субмикронных до нанометровых диаметров. В типичной установке для высокого напряжения. Накопление электростатического отталкивания в заряженном растворе заставляет его выбрасывать тонкую волокнистую струю. Установленная пластина коллектора или стержень с противоположным или заземляющим зарядом в непрерывные волокна, которые поступают, образуя высокопористую сеть. Основными преимуществами этого метода являются его простота и легкость изменения. На лабораторном уровне типичной установки электропрядения требуется только источник высокого напряжения (до 30 кВ), шприц, игла с наконечником и токопроводящий коллектор. По этим причинам электроспиннинг стал обычным методом изготовления каркасов во многих лабораториях. Изменяя такие переменные, как до коллектора, приложенного напряжения или скорости потока, исследователи резко увеличивают общую мощность каркаса.
Исторически исследования электропряденых волокнистых каркасов восходят, по крайней мере, к концу 1980-х годов, когда Саймон показал, что электроспиннинг может быть использован для производства волокнистых каркасов нано- и субмикронного масштаба из решений полимеров, специально предназначенных для использования в качестве клеток in vitro. и тканевые субстраты. Это раннее использование электроспрядных решеток для культивирования клеток и тканевой инженерии показало, что различные клетки будут прилипать к полбонатным волокнам и размножаться на них. Было отмечено, что в отличие от уплощенной морфологии, обычно наблюдаемой в 2D-культуре, клетки, выращенные на электроспряд волокнах, демонстрируют более округлую трехмерную морфологию, обычно наблюдаемую в тканях in vivo.
Положения-первые вышеперечисленные методы ограничены, когда дело доходит до контроля пористости и размера пор, в тканевой инженерии были внедрены методы компьютерного проектирования и производства. Во-первых, с помощью программного обеспечения CAD создается трехмерная структура. Пористость можно настроить с помощью алгоритмов в программном правительстве. Каркас реализуется с помощью струйной печати полимерных порошков или с помощью моделирования осаждения плавлением расплава полимера.
Исследование 2011 г., проведенное El-Ayoubi et al. исследовал «метод построения трехмерных графиков для получения (биосовместимых и биоразлагаемых ) макропористых каркасов формы поли-L-лактида с двумя разными размерами пор» посредством изготовления твердого тел свободного (SSF) с помощью компьютера Aided-Design (CAD), чтобы исследовать терапевтическую замену суставного хряща как «альтернативу традиционному восстановлению тканей». Исследование показало, что чем меньше размер пор в сочетании с механическим напряжением в биореакторе (для создания условий, подобных in vivo), тем выше жизнеспособность клеток с точки зрения потенциальной терапевтической функциональности за счет уменьшения времени восстановления и повышения эффективности трансплантата.
В исследовании 2012 года Koch et al. фокусируется на том, можно использовать лазерную биопечать (LaBP) для построения трехмерных узоров в естественной матрице, а также на том, функционируют ли созданные конструкции и формируют ли они ткань. LaBP собирает небольшие объемы суспензий живых клеток в заданные шаблоны с высоким разрешением. Исследование было успешным, исследователи предвидят, что «созданные тканевые конструкции могут быть использованы для тестирования in vivo путем имплантации их в модели на животных » (14). На момент проведения данного исследования была синтезирована ткань кожи человека, исследователи прогнозируют, что «интеграция дополнительных типов клеток (например, меланоцитов, клеток Шванна, клеток волосяных фолликулов) в отпечатанных клетках. конструкции этих клеток в трехмерном in vitro микроокружении, аналогичном их естественном, может быть проанализировано ", что полезно для открытия лекарств и токсикологических исследований.
Густафссон и др. продемонстрировали отдельно стоящие биоактивные мембраны размером сантиметр, но толщиной всего 250 нм, которые были образованы путем самосборки паучьего шелка на границе раздела водного раствора. мембраны уникальным образом сочетают наноразмерную толщину, биоразлагаемость, сверхвысокую деформацию и прочность, проницаемость для белков и способствуют быстрому прикреплению и пролиферации клеток. Они продемонстрировали рост когерентного слоя кератиноциты.
Одной из постоянных, постоянных проблем тканевой инженерии являются ограничения массопереноса. Сконструированные ткани обычно не имеют начального кровоснабжения, что затрудняет получение имплантированными клетками достаточного количества кислорода и питательных веществ для выживания или правильного функционирования.
Методы самосборки оказались многообещающими методами тканевой инженерии. Методы самосборки имеют то преимущество, что они позволяют тканям развивать свой собственный внеклеточный матрикс, в результате чего ткань лучше воспроизводит биохимические и биомеханические свойства нативной ткани. Самособирающийся искусственный суставной хрящ был предложен Джерри Ху и Кириакосом А. Атанасиу в 2006 году, и применение этого процесса привело к созданию искусственного хряща, близкого к прочности нативной ткани. Самосборка - это основная технология, позволяющая выращивать клетки в лаборатории и собирать их в трехмерные формы. Чтобы расщепить ткани на клетки, исследователи сначала должны растворить внеклеточный матрикс, который обычно связывает их вместе. Когда клетки изолированы, они должны образовывать сложные структуры, из которых состоят наши естественные ткани.
Поверхность воздух-жидкость, созданная волнами Фарадея, исследуется как шаблон для сборки биологических объектов для восходящей тканевой инженерии. Этот шаблон на жидкой основе можно динамически реконфигурировать за несколько секунд, и сборка на шаблоне может быть выполнена масштабируемым и непрерывным способом. Была установлена сборка микромасштабных гидрогелей, клеток, бусинок микроносителей с засеянными нейронами, клеточных сфероидов в различных симметричных и периодических структурах с хорошей жизнеспособностью клеток. Формирование трехмерной нейронной сети было достигнуто после 14-дневного культивирования ткани.
Возможно, можно будет печатать органы или, возможно, целые организмы, используя методы аддитивного производства. В новейшем инновационном методе конструирования используется струйный механизм печати точных клеток клеток в матрице из термообратимого геля. Эндотелиальные клетки, клетки, выстилающие кровеносные сосуды, напечатаны в виде набора колец. При инкубации они сливаются в пробирку.
Благодаря быстрому способу создания тканей и целых органов с использованием 3D-принтера впервые появилась система благодаря множеству проектов и технологий. которые могут слой за слоем печатать каркас и клетки в образце рабочей ткани или органе. Устройство представило в выступлении на TED доктором Энтони Атала, доктором медицины, директором Уэйк Форест Института регенеративной медицины и W.H. Бойс, профессор и заведующий кафедрой урологии Университета Уэйк-Форест, где почка печатается на сцене во время семинара и затем представлена публике. Ожидается, что эта технология в будущем позволит получить печень для трансплантации, а также теоретически для токсикологии и других биологических исследований.
Недавно многофотонная обработка (МПП) была проведена для экспериментов in vivo путем создания искусственных хрящевых конструкций. Гистологическое исследование ex vivo показало, что определенная геометрия и предварительный рост хондроцитов (Cho) до имплантации улучшает характеристики трехмерных каркасов. Достигнутая биосовместимость была сопоставима с коммерчески доступными коллагеновыми мембранами. Успешный результат этого исследования подтверждает идею о том, что гибридные органически-неорганические микроструктурированные каркасы с гексагональной порой в сочетании с Ch o посев могут быть успешно применены для инженерии хрящевой ткани.
В 2013 году использование 3-х мерного каркаса из Матригеля в различных конфигурациях, существенная поджелудочная железа органоиды были получены in vitro. Кластеры из небольшого количества клеток пролиферировали до 40 000 клеток в течение одной недели. Кластеры трансформируются в клетки, которые производят пищеварительные ферменты или гормоны, такие как инсулин, самоорганизующиеся в разветвленные органоиды поджелудочной железы, похожие на поджелудочную железу.
Клетки чувствительны к окружающей среде, например к жесткости геля и контакту с другими клетками. Отдельные клетки не процветают; для последующего развития органоидов требовалось минимум четыре ближайших клетки. При изменении состава среды образуются либо полые сферы, состоящие из предшественников поджелудочной железы, либо сложные органоиды, которые подвергаются воздействию морфогенезу и дифференцировке поджелудочной железы. Поддержание и распространение предшественников поджелудочной железы требует активной передачи сигналов Notch и FGF, воспроизводящих сигнальные взаимодействия ниш in vivo.
Органоиды рассматривались как предлагающие мини-органы для лекарств.
Во многих случаях функциональные возможности тканей и биологических структур in vitro требует обширного культивирования для обеспечения роста и стимулирования функциональности. Как правило, в культуре должны поддерживаться основные потребности клеток, которые включают кислород, pH, влажность, температуру, питательные вещества и осмотическое давление обслуживание.
Культуры с тканевой инженерией также дополнительные проблемы при поддержании условий культивирования. В стандартной культуре клеток диффузия часто используется средством питательных веществ и метаболитов. По мере того, как культура становится больше и сложнее, как в случае с искусственными средствами искусственного интеллекта, созданными механизмами для поддержания культуры коммуникатора другие, такие как капиллярные сети внутри страны.
 Биореактор для культивирования сосудистых трансплантатов
Биореактор для культивирования сосудистых трансплантатов Еще одна проблема с культурой среды - введение соответствующих факторов или стимулов, необходимых для индукции функциональности. Во многих случаях простой культуры обслуживания недостаточно. Факторы роста, гормоны, физические и физические стимулы. Например, некоторые клетки реагируют на изменения давления кислорода как часть своего нормального развития, например, хондроциты, которые должны адаптироваться к условиям низкого содержания кислорода или гипии во время развития скелета. Другие, такие как эндотелиальные клетки, реагируют на напряжение от потока жидкости, которое встречается в кровеносных сосудах. Механические стимулы, такие как импульсы давления, по-видимому, полезны для всех видов сердечно-сосудистой ткани, такой как сердечные клапаны, кровеносные сосуды или перикард.
Биореактор в тканевой инженерии, в отличие от промышленных биореакторов, представляет собой устройство, которое пытается моделировать физиологическую среду, организм клеток или тканей in vitro. Физиологическая среда может состоять из множества параметров, таких как температура и параметры кислорода или углекислого газа, но может распространяться на все виды биологических, химических или механических раздражителей. Следовательно, существуют системы, которые могут включать приложение сил или напряжений к ткани или даже электрического тока в двух- или трехмерных установках.
В академических и промышленных исследовательских центрах биореакторы, как правило, разрабатываются таким образом, чтобы воспроизводить специфические физиологические условия выращиваемой ткани (например, гибкость и сдвиг жидкости для роста сердечной ткани). Несколько биореакторов общего назначения также доступны для использования в системе статической химической стимуляции или комбинацию химической стимуляции.
Существует множество биореакторов, разработанных для трехмерных культурных клеток. Существуют небольшие пластиковые цилиндрические камеры, а также стеклянные камеры с регулируемой внутренней влажностью и влажностью, специально разработанные для выращивания клеток в трех измерениях. В биореакторе используются биоактивные синтетические материалы, такие как полиэтилентерефталатные мембраны, для окружения сфероидных клеток в среде, поддерживает высокие уровни питательных веществ. Их легко открывать и закрывать, так что клеточные сфероиды могут быть удалены для тестирования, но при этом камера способна поддерживать 100% влажность повсюду. Эта влажность важна для достижения роста и функционирования клеток. Камера биореактора является частью большего устройства.
QuinXell Technologies теперь под Quintech Life Sciences из Сингапур разработала биореактор, известный как TisXell Biaxial Bioreactor, который разработан специально для тканевой инженерии. Это первый биореактор в мире, имеющий сферическую стеклянную камеру с двухосным вращением; специально для имитации вращения плода в утробе матери; который обеспечивает благоприятную среду для роста тканей.
MC2 Biotek также разработала биореактор, известный как ProtoTissue, в котором используется газообмен для поддержания высокого уровня кислорода в камере клетки; улучшается по сравнению с предыдущими биореакторами, потому что более высокий уровень кислорода помогает развить нормальное клеточное дыхание.
В 2013 году группа из Токийского университета клеточные волокна до метр длиной и размером порядка 100 мкм. Эти новые основы использования микрофлюидного устройства , которое формирует двойной коаксиальный ламинарный поток. Каждый «слой» микрофлюидного устройства (клетки, засеянные в ECM, оболочка из гидрогеля и, наконец, раствор хлорида кальция). Посевные культуры клеток в гидрогелевой оболочке в течение нескольких дней, а затем оболочка удаляется с жизнеспособными клеточными волокнами. В ядро ЕСМ были вставлены клетки различных типов, включая миоциты, эндотелиальные клетки, нервные клетки и волокна эпителиальных клеток. Затем эта группа показала, что эти волокна могут быть сплетены вместе для изготовления тканей или органов по механизму, подобному текстильному ткачеству. "Преимущество фиброзной морфологии" состоит в том, что она представляет собой альтернативу традиционной конструкции каркаса, многие органы (например, мышцы) состоят из фиброзных клеток.
Искусственный орган - это искусственное устройство, которое имплантируется или интегрируется в организм человека для замены естественного органа с целью восстановления функций или группы связанных функций, чтобы пациент мог вернуться к нормальной жизни как можно скорее. Заменяемая функция не должна обязательно быть связана с жизнеобеспечением, но часто так бывает. Конечная цель тканевой инженерии как дисциплины включает в себя готовые биоискусственные органы, так и регенерацию поврежденных тканей организма. Чтобы успешно создать биоискусственные органы из стволовых клеток пациентов, исследователи продолжают совершенствовать сложные ткани с тканевой инженерии. Например, многие исследования на понимание наноразмерных сигналов, присутствующих в микросреде клетки.
Биомиметика - это область, которая направлена на производство материалов и систем, которые воспроизводят те, что присутствуют в природе. В универсальном подходе тканевой инженерии для создания материалов для этих приложений, которые сопоставимы с нативными тканями с точки зрения их структуры, структуры и биосовместимости. Свойства материала в силе от физических, структурных и химических материалов этого материала. Вперед биомиметический подход к проектированию системы необходимых при интеграции материалов, требуется понимание биологических и взаимодействий. Репликация биологических систем и процессов также может быть при синтезе био-вдыхаемых материалов для достижения условий, которые производят желаемый биологический материал. Следовательно, если синтезируется материал, имеющий одинаковые характеристики биологических тканей как структурно, так и химически, то в идеале синтезированный материал будет иметь аналогичные свойства. Этот метод имеет обширную историю использования природных явлений в качестве источника вдохновения для человеческих проблем. Многие современные достижения в области технологий были вдохновлены природой и природными системами. Достижения в области нанотехнологий инициировали применение этой техники микро- и наномасштаба, включая тканевую инженерию. Этот метод был использован для разработки синтетических костных тканей, сосудистых технологий, строительных материалов и методов интеграции, а также функционализированных наночастиц.
В 2018 году ученые Университета Брандейса сообщили об их исследованиях мягких материалов, встроенных в химические сети, которые могут имитировать гладкое и скоординированное поведение нервной ткани. Это исследование финансировалось США. Армейская исследовательская лаборатория. Исследователи представили экспериментальную систему нейронных сетей, теоретически смоделированную как систему реакции-диффузии. Внутри сетей находился ряд реакторов, каждый из которых выполнял реакцию Белоусова-Жаботинского (BZ). Эти реакторы могли работать в нанолитровом масштабе.
Исследователи заявляют, что вдохновением для их проекта послужило движение синего ленточного угря. Движения угря контролируются электрическими импульсами, определяемыми классом нейронных сетей, называемым центральным генератором паттернов. Генераторы центральныхтернов работают в вегетативной нервной системе для управления такими функциями организма, как дыхание, движение и перистальтика.
Качествами реактора, которые были спроектированы, были топология сети, граничные условия, начальные условия, объем реактора, сила связи и синаптическая полярность реактора (является ли его поведение тормозящим или возбуждающим). Была изменена эмульсионная система BZ с твердым эластомером полидиметилсилокс (ПДМС). Сообщается, что как светопроницаемый, так и проницаемый для брома PDMS являются жизнеспособными методами для создания кардиостимулятора для нейронных сетей.
Историю рынка тканевой инженерии можно разделить на три основные части. Время до краха рынка биотехнологий в начале 2000-х, краха и время после него.
Самый ранний прогресс в исследованиях тканевой инженерии был достигнут в США. Это связано с менее строгими правилами в отношении исследований стволовых клеток и более доступным финансированием, чем в других странах. Это приводит к созданию академических стартапов, многие из которых приведены из Гарварда или MIT. Примерами являются BioHybridTechnologies, основатель которой Билл Чик учился в Гарвардской медицинской школе и сосредоточился на создании искусственной поджелудочной железы. Другой пример - компания Organogenesis Inc., основатель которой перешел в Массачусетский технологический институт и работал над продуктами для ухода за кожей. Другие компании, связанные с MIT, - это TEI Biosciences, Therics и Guilford Pharmaceuticals. Возобновление интереса к биотехнологиям в 1980-х годах приводит к тому, что многие частные инвесторы вкладывают средства в эти новые технологии, даже несмотря на то, что бизнес-модели ранних стартапов часто были не очень ясными и не открывали путь к долгосрочной прибыльности. Государственные спонсоры были более сдержанны в своем финансировании, поскольку тканевая инженерия считалась вложением с высоким риском.
В Великобритании рынок начал медленнее, несмотря на то, что правила исследования стволовых клеток тоже не были строгими. В основном это связано с тем, что большее количество инструментов меньше, вкладывают средства в эти новые технологии. Еще одна проблема, заключающаяся в том, чтобы заключить британские компании, заключалась в том, чтобы заставить NHS платить за их продукцию. Это особенно с тем, что NHS проводит анализ экономической эффективности всех поддерживаемых продуктов. Новые технологии часто не работают в этом отношении.
В Японии ситуация с регулированием была совершенно иной. Первое культивирование клеток было разрешено только в условиях больницы, а вторым ученым, работающим в государственном университетах, не разрешалось работать по совместительству до 1998 года. Более того, японским властям потребовалось больше времени для утверждения новых лекарств и методов лечения, чем у американских и европейских коллег.
По этим причинам в первые дни японского рынка особое внимание уделяется приобретению продуктов, которые уже были одобрены в других местах Японии, и их продаже. На рынке США первыми игроками фирмы в Японии были в основном крупные или дочерние компании крупных фирм, как J-TEC, Menicon и Terumo, а не маленькие стартапы. В 2014 году они начали разрабатывать свои собственные продукты.
Японские компании, такие как ReproCell и iPS Academia Japan, в настоящее время работают над продуктами, связанными с ячейкой iPS.
Вскоре после большого бума начали появляться первые проблемы. Были проблемы с получением продуктов, одобренных FDA, и если они были одобрены, они были одобрены с привлечением услуг страховых компаний к оплате продуктов и их принятием поставщиками медицинских услуг.
Например, Компания "Генез" столкновения с проблемами, связанными с маркетингом своего продукта и его интеграцией в систему здравоохранения. Частично это связано с использованием этих продуктов по сравнению с обычными методами.
Другим примером может быть продукт для кожи Advanced Tissue Sciences Dermagraft, который не мог бы создать достаточно высокий спрос без возмещения от страховых компаний. Причина этого была цена в 4000 долларов и тот факт, что компания Additional Advanced Tissue Sciences изо всех сил пыталась привлечь внимание врачей к своему продукту.
Приведенные выше примеры демонстрируют, как компании боролись за получение прибыли. Это, в свою очередь, приводит к тому, что инвесторы теряют терпение и прекращают дальнейшее финансирование. В результате в начале 2000-х годов несколько компаний по тканевой инженерии, такие как органогенез и современные тканевые науки, объявили о банкротстве. В то время они имели на рынке коммерческие продукты для кожи.
Технологии обанкротившихся или испытывающих трудности компаний часто покупались компании, которые продолжали развитие консервативные бизнес-модели. Примерами компаний, которые продавали свою продукцию после складывания, были Curis и Intercytex.
Многие из компаний отказались от своих долгосрочных целей разработки полнофункциональных органов в пользу продуктов и технологий, которые могли бы принести прибыль в краткосрочной перспективе. Примерами таких продуктов являются продукты для косметической и тестовой промышленности.
В других случаях, например, в случае Advanced Tissue Sciences, основатели основывали новые компании.
В 2010-х годах нормативно-правовая база также начала способствовать ускорению выхода на рынок, особенно в США, поскольку новые центры и пути были созданы FDA специально для продуктов, полученных из живых клеток, таких как Центр оценки и исследований биологических препаратов.
Первые продукты тканевой инженерии начали получать коммерческую прибыль в 2010-х.
В Европе регулирование в настоящее время разделено на три области регулирования: медицинские устройства, лекарственные средства и биопрепараты. Продукты Tissue Engineering часто имеют гибридную природу, поскольку они часто состоят из клеток и поддерживающей структуры. В то время как некоторые продукты могут быть одобрены как лекарственные средства, другие должны получить одобрение как медицинские устройства. Дерксен объясняет в своей диссертации, что исследователи тканевой инженерии иногда сталкиваются с регулированием, которое не соответствует характеристикам тканевой инженерии.
В Европе наблюдаются новые режимы регулирования, которые решают эти проблемы. Объяснение трудностей в достижении консенсуса регулирующих органов в этом вопросе дает исследование, проведенное в Великобритании. Авторы объясняют эти проблемы тесной взаимосвязью и пересечением с другими технологиями, такими как ксенотрансплантация. Поэтому регулирующие органы не могут заниматься этим отдельно. Регулирование дополнительно осложняется этическими противоречиями, связанными с этой и смежными областями исследований (например, противоречие стволовых клеток, этика трансплантации органов ). Тот же опрос, упомянутый выше, показывает на примере трансплантации аутологичного хряща, что конкретная технология может рассматриваться как «чистая» или «загрязненная» одним и тем же социальным субъектом.
Два регуляторных движения наиболее актуальны для тканевой инженерии в Европейском Союзе. Это Директива о стандартах качества и безопасности для источников и обработки человеческих тканей, которая была принята Европейским парламентом в 2004 году, а также предлагаемый регламент о клетках и изделиях из тканей человека. Последний был разработан под руководством ГД по предприятиям Европейской комиссии и представлен в Брюсселе в 2004 году.
| На Викискладе есть средства массовой информации, связанные с тканевой инженерией. |