 | |
 | |
| Имена | |
|---|---|
| Предпочтительное название IUPAC 2,3-Дигидроксибутандиовая кислота | |
| Другие имена Винная кислота. 2,3-Дигидроксисукциновая кислота. Треариновая кислота. Рацемическая кислота. Увиновая кислота. Паравинтарная кислота. Винестон | |
| Идентификаторы | |
| Номер CAS | |
| 3D-модель (JSmol ) | |
| ChEBI | |
| ChEMBL |
|
| ChemSpider | |
| DrugBank | |
| ECHA InfoCard | 100.121.903 |
| KEGG | |
| MeSH | винная кислота + кислота |
| PubChem CID | |
| Панель управления CompTox (EPA ) | |
InChI
| |
УЛЫБКИ
| |
| Свойства | |
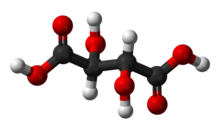
| Химическая формула | C4H6O6(Основная формула). HO2C CH (OH) CH (OH) CO 2H (Структурная формула) |
| Молярная масса | 150,087 г / моль |
| Внешний вид | Белый порошок |
| Плотность | 1,79 г / мл (H 2 O) |
| Точка плавления | от 171 до 174 ° C (от 340 до 345 ° F; От 444 до 447 K) (L или D-винная кислота; чистый). 206 ° C (DL, рацемический). 165–166 ° C (мезо-безводный). 146–148 ° C (мезоводородный) |
| Растворимость в воде |
|
| Кислотность (pK a) | L (+) 25 ° C:. pKa1= 2,89, pK a2 = 4,40. мезо 25 ° C:. pKa1= 3,22, pK a2 = 4,85 |
| Основание конъюгата | Битартрат |
| Магнитная восприимчивость (χ) | -67,5 · 10 см / моль |
| Опасности | |
| Классификация ЕС (DSD) (устаревшее) | Раздражающее (Xi) |
| R-фразы (устаревшие) | R36 |
| Родственные соединения | |
| Другие катионы | Тартрат натрия. Тартрат динатрия. Тартрат монокалия. Тартрат калия |
| Родственные карбоновые кислоты | Масляная кислота. Янтарная кислота. Димеркаптоянтарная кислота. Яблочная кислота. Малеиновая кислота. Фумаровая кислота |
| Родственные соединения | 2,3-Бутандиол. Цихоровая кислота |
| Если не указано иное, данные приведены для материалов в их стандартном состоянии. te (при 25 ° C [77 ° F], 100 кПа). | |
| Ссылки в ink | |
Винная кислота - белый, кристаллическая органическая кислота, которая встречается в природе во многих фруктах, особенно в винограде, но также в бананах, тамариндах и цитрусовые. Его соль, битартрат калия, широко известный как винный камень, естественным образом образуется в процессе ферментации. Он обычно смешивается с бикарбонатом натрия и продается как разрыхлитель, используемый в качестве разрыхлителя при приготовлении пищи. Сама кислота добавляется в пищевые продукты как антиоксидант E334 и для придания им характерного кислого вкуса.
Винная кислота представляет собой альфа-гидрокси- карбоновую кислоту, имеет дипротон и альдаровую кислоту по кислотным характеристикам и является дигидроксильным производным янтарная кислота.
Винная кислота виноделам веками известна. Письменные записи о его извлечении из остатков виноделия были сделаны около 800 г. н.э. алхимиком Джабиром ибн Хайяном. Химический процесс экстракции был разработан в 1769 г. шведским химиком Карлом Вильгельмом Шееле.
Винная кислота сыграла важную роль в открытии химической хиральности. Это свойство винной кислоты впервые было обнаружено в 1832 году Жаном Батистом Био, который обнаружил ее способность вращать поляризованный свет. Луи Пастер продолжил это исследование в 1847 году исследуя формы кристаллов тартрата натрия-аммония, которые он обнаружил хиральными. Путем сортировки кристаллов разной формы вручную Пастер первым произвел чистый образец левотаровой кислоты.
 Кристаллы винной кислоты, нарисованные так, как если бы они были видны в оптический микроскоп
Кристаллы винной кислоты, нарисованные так, как если бы они были видны в оптический микроскоп Естественно винная кислота является хиральной и является полезным сырьем в органическом химическом синтезе. Встречающаяся в природе форма кислоты - это декстротартаровая кислота или L- (+) - винная кислота (устаревшее название d -винная кислота). Поскольку он доступен в природе, он немного дешевле, чем его энантиомер и мезо-изомер. Префиксы dextro и levo - устаревшие термины. В современных учебниках природная форма упоминается как (2R, 3R) -винная кислота (L- (+) - винная кислота), а ее энантиомер - как (2S, 3S) -винная кислота (D- (-) -винная кислота) . Мезо-диастереомер представляет собой (2R, 3S) -винную кислоту (которая идентична «(2S, 3R) -винной кислоте»).
В то время как два хиральных стереоизомера вращают плоско-поляризованный свет в противоположных направлениях, растворы мезо-винной кислоты не вращают плоско-поляризованный свет. Отсутствие оптической активности связано с зеркальной плоскостью в молекуле [сегментированная линия на рисунке ниже].
Винная кислота в растворе Фелинга связывается с ионами меди (II), предотвращая образование нерастворимых гидроксидных солей.
| DL-винная кислота (рацемическая кислота ) (при соотношении 1: 1) | мезотартаровая кислота | |
|---|---|---|
| декстротарная кислота. (L- (+) - винная кислота) | левотарная кислота. (D- (-) - винная кислота) | |
 |  |  |
| Общепринятое название | Винная кислота | Левотарная кислота | Декстротарная кислота | Мезотартаровая кислота | Рацемическая кислота |
|---|---|---|---|---|---|
| Синонимы | (2S, 3S) -винная кислота. (S, S) -винная кислота. (-) -винная кислота. 1-винная кислота (устаревшая). левотарная кислота. D-винная кислота. D-реариновая кислота. («неприродный изомер») | (2R, 3R) -винная кислота. (R, R) -винная кислота. (+) - винная кислота. d-винная кислота (устаревшая). L-винная кислота. L-реариновая кислота. ('природный изомер') | (2R, 3S) винная кислота. мезо-винная кислота. эритаровая кислота | рац- (2R, 3S) винная кислота. (2RS, 3SR) -винная кислота. (±) -винная кислота. DL-винная кислота. dl-винная кислота ( устаревшая). паравинная кислота. увиновая кислота | |
| PubChem | CID 875 от PubChem | CID 439655 от PubChem | CID 444305 от PubChem | CID 78956 от PubChem | CID 5851 от PubChem |
| номер EINECS | 205-695-6 | 201-766-0 | 205-696-1 | 205-105-7 | |
| Номер CAS | 526-83-0 | 147-71-7 | 87-69-4 | 147-73- 9 | 133-37-9 |
L - (+) - Изомер винной кислоты винной кислоты кислота производится промышленным способом в наибольших количествах. Его получают из осадка, твердого побочного продукта ферментации. Первые побочные продукты в основном состоят из битартрата калия (KHC 4H4O6). Эта калиевая соль превращается в тартрат кальция (CaC 4H4O6) при обработке известковым молоком (Ca (OH) 2):
На практике более высокие выходы тартрата кальция получают с добавлением хлорида кальция. Затем тартрат кальция превращают в винную кислоту обработкой соли водной серной кислотой:
рацемическая винная кислота (т.е. смесь 50:50 из D - (-) - винной кислоты и L - (+) - молекул винной кислоты, рацемическая кислота ) может быть получена многостадийной реакцией из малеиновой кислоты. На первой стадии малеиновая кислота эпоксидируется с помощью перекиси водорода с использованием в качестве катализатора.
На следующем этапе эпоксид гидролизуют.
мезо-винная кислота образуется посредством термической изомеризации. декстро-винную кислоту нагревают в воде при 165 ° C в течение примерно 2 дней. мезо-винная кислота также может быть получена из дибромянтарной кислоты с использованием гидроксида серебра:
мезо-винная кислота может быть отделена от остаточной рацемической кислоты путем кристаллизации, причем рацемат менее растворим.
L - (+) - винная кислота, может участвовать в нескольких реакциях. Как показано на схеме реакции ниже, дигидроксималеиновая кислота образуется при обработке L - (+) - винной кислоты пероксидом водорода в присутствии соли двухвалентного железа.
Затем дигидроксималеиновая кислота может быть окислена до тартроновой кислоты азотной кислотой.
 рвотный камень
рвотный камень  Коммерчески производимая винная кислота
Коммерчески производимая винная кислота Важные производные винной кислоты, включая ее соли, винный камень (битартрат калия ), соль Рошеля (тартрат калия-натрия, слабое слабительное ) и зубной камень рвотное (тартрат калия сурьмы). Диизопропилтартрат используется в качестве сокатализатора в асимметричном синтезе.
Винная кислота - это мышечный токсин, который действует, подавляя выработку яблочной кислоты, и в высоких дозах вызывает паралич и смерть. Средняя летальная доза (LD 50) составляет около 7,5 г / кг для человека, 5,3 г / кг для кроликов и 4,4 г / кг для мышей. Учитывая эту цифру, для убийства человека весом 70 кг (150 фунтов) потребуется более 500 г (18 унций), поэтому его можно безопасно включать во многие продукты, особенно в сладости с кислинкой. В качестве пищевой добавки винная кислота используется в качестве антиоксиданта с номером E E334 ; тартраты - это другие добавки, служащие антиоксидантами или эмульгаторами.
. При добавлении зубного камня в воду образуется суспензия, которая очень хорошо очищает медные монеты, так как Раствор винной кислоты может растворить слой оксида меди (II), присутствующий на поверхности монеты. Образовавшийся комплекс тартрата меди (II) легко растворяется в воде.
 Неочищенный битартрат калия может приобретать цвет виноградного сока, из которого он был выделен.
Неочищенный битартрат калия может приобретать цвет виноградного сока, из которого он был выделен. Винная кислота может быть легко узнаваема любителями вина как источник «вина» алмазы », мелкие кристаллы битартрата калия, которые иногда спонтанно образуются на пробке или дне бутылки. Эти «тартраты» безвредны, несмотря на то, что их иногда ошибочно принимают за битое стекло, и во многих винах их предотвращают с помощью стабилизации холода (что не всегда является предпочтительным, поскольку оно может изменить профиль вина). Тартраты, оставшиеся внутри бочек для выдержки, когда-то были основным промышленным источником битартрата калия.
Винная кислота играет важную химическую роль, понижая pH ферментирующего «сусла» до уровня, при котором многие нежелательные бактерии порчи не могут жить, и действует как консервант после ферментации. Во рту винная кислота придает вину некоторую терпкость, хотя лимонная и яблочная кислоты также играют роль.
Результаты исследования показали, что в цитрусовых, фрукты, выращенные в органическом земледелии, содержат более высокие уровни винной кислоты, чем фрукты, произведенные в традиционном сельском хозяйстве.
Винная кислота, похоже, увеличивает критическую температуру в некоторых сверхпроводниках, предположительно повышая степень окисления, хотя механизм этого явления до сих пор точно не известен.
Винная кислота и ее производные находят множество применений в области фармацевтики. Например, его использовали в производстве шипучих солей в сочетании с лимонной кислотой для улучшения вкуса пероральных лекарств. Антимониловое производное калия кислоты, известной как рвотный камень, входит в малых дозах в сироп от кашля в качестве отхаркивающего средства.
Винная кислота также имеет несколько применений для промышленного использования. Было обнаружено, что кислота хелатирует ионы металлов, таких как кальций и магний. Таким образом, кислота использовалась в сельском хозяйстве и металлургической промышленности в качестве хелатирующего агента для образования комплексных питательных микроэлементов в почве удобрения и для очистки металлических поверхностей, состоящих из алюминия, меди, железа и сплавов этих металлов, соответственно.
| Викискладе есть носители, связанные с винной кислотой. |