 Аксо-аксональный закрытый синапс: нейрон C блокирует синапс между нейроном A и B.
Аксо-аксональный закрытый синапс: нейрон C блокирует синапс между нейроном A и B. Синаптическое стробирование - это способность нейронных цепей управлять входными сигналами путем подавления или облегчения определенной синаптической активности. Избирательное ингибирование определенных синапсов было тщательно изучено (см. Теория боли Гейт ), и недавние исследования подтвердили существование разрешающей стробированной синаптической передачи. В общем, синаптическое стробирование включает механизм центрального контроля над выходом нейронов. Он включает в себя своего рода нейрон- привратник, который имеет способность влиять на передачу информации выбранным целям независимо от частей синапса, на которые он оказывает свое действие (см. Также нейромодуляцию ).
Бистабильные нейроны обладают способностью колебаться между гиперполяризованным (нижнее состояние) и деполяризованным (верхнее состояние) мембранным потенциалом покоя без активации потенциала действия. Таким образом, эти нейроны можно назвать верхними / нижними нейронами. Согласно одной модели, эта способность связана с присутствием глутаматных рецепторов NMDA и AMPA. Внешняя стимуляция рецепторов NMDA отвечает за перевод нейрона из нижнего состояния в активное состояние, в то время как стимуляция рецепторов AMPA позволяет нейрону достичь и превзойти пороговый потенциал. Нейроны, которые обладают этой бистабильной способностью, имеют потенциал для стробирования, потому что внешние нейроны-привратники могут модулировать мембранный потенциал стробируемого нейрона, выборочно переводя их из верхнего состояния в нижнее. Такие механизмы наблюдались в прилежащем ядре с привратниками, берущими свое начало в коре, таламусе и базальных ганглиях.
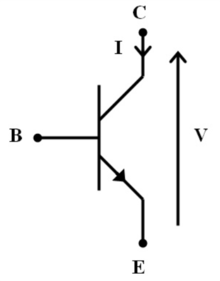 Пример биполярного переходного транзистора, который можно использовать в качестве модели для синаптического стробирования. B будет представлять нейрон привратника, который регулирует передачу сигнала от C к E.
Пример биполярного переходного транзистора, который можно использовать в качестве модели для синаптического стробирования. B будет представлять нейрон привратника, который регулирует передачу сигнала от C к E. Модель закрытых синапсов была первоначально получена из модели электронной схемы, в которой привратник служит транзистором в цепи. В схеме транзистор может действовать как переключатель, который включает или выключает электрический сигнал. Кроме того, транзистор может служить для усиления существующего тока в цепи. По сути, нейрон-привратник действует как транзистор закрытого синапса, модулируя передачу сигнала между пресинаптическими и постсинаптическими нейронами.
В модельном закрытом синапсе ворота по умолчанию либо открыты, либо закрыты. Таким образом, нейрон-привратник служит внешним переключателем ворот в синапсе двух других нейронов. Один из этих нейронов обеспечивает входной сигнал, а другой - выходной сигнал. Роль нейрона-привратника - регулировать передачу входа на выход. При активации нейрон привратника изменяет полярность пресинаптического аксона, открывая или закрывая ворота. Если этот нейрон деполяризует пресинаптический аксон, он позволяет передавать сигнал. Таким образом, ворота открыты. Гиперполяризация пресинаптического аксона закрывает ворота. Как и в транзисторе, нейрон привратника включает или выключает систему; он влияет на выходной сигнал постсинаптического нейрона. Включен он или выключен, зависит от природы входного сигнала (возбуждающего или тормозящего) от пресинаптического нейрона.
Стробирование может происходить путем шунтирующего торможения, при котором тормозящие интернейроны изменяют проводимость мембраны возбуждающего аксона-мишени, тем самым распространяя его возбуждающий сигнал. Стробирующий сигнал от привратника запускает эти тормозные интернейроны, чтобы предотвратить срабатывание одного набора нейронов даже при стимуляции другим набором. В этом состоянии ворота закрыты. Примеры такого рода стробирования были обнаружены в зрительных корковых нейронах и областях префронтальной коры (ПФК) у приматов, которые могут быть ответственны за подавление нерелевантных стимулов. Исследования показывают, что такое ингибирование частично может быть связано с синапсами, опосредованными рецепторами ГАМК.
Чтобы эти тормозящие интернейроны действовали на свои цели, они должны получить входной сигнал от привратника, который их стимулирует. Этот вход может быть внутренним, внешним или и тем, и другим. Внешний ввод поступает из области мозга, анатомически и функционально отличной от данной цепи, в то время как внутренний ввод поступает от частей самой схемы. Обычно этот ввод происходит в форме нейромодулирующих веществ, таких как гормоны, нейропептиды и другие нейротрансмиттеры, которые высвобождаются из входящих нейронов. Затем эти сигналы сходятся на привратнике, где они интегрируются и направляются к цели. В зависимости от схемы, стробирующие сигналы могут поступать из разных областей мозга. Например, исследования показали, что энторинальная кора может закрывать области медиального ПФК, тем самым препятствуя их проецированию в другие области мозга.
Дополнительные исследования показали, что таламус также может служить источником стробирующих сигналов. На пути между PFC и гиппокампом стимуляция медиодорсальных таламических нейронов, а также стимуляция нейронов вентральной тегментальной области ингибировала возбуждение нейронов PFC. Было показано, что эти ингибирующие эффекты модулируются различными антагонистами дофаминовых рецепторов, что предполагает некоторую роль дофамина как нейромодулирующего агента в этой цепи.
Из-за ограниченной способности мозга обрабатывать информацию становится необходимым, чтобы мозг имел способность отфильтровывать ненужную информацию и выбирать важную. Вход, особенно в поле зрения, требует избирательного внимания. Модели стробирующих механизмов в процессе внимания изучались многими группами исследователей, однако консенсуса относительно роли синаптического стробирования во внимании не достигнуто.
Механизмы вентиляции в базальных ганглиях связаны с нашей способностью фильтровать нерелевантную информацию и получать доступ к соответствующей информации из рабочей памяти. В этом случае за функцию контроля ворот отвечает таламус. Он открывает ворота между двумя областями коры головного мозга, позволяя влиять на стимулы в рабочей памяти. Однако таламус тонически подавляется базальными ганглиями. Активация базальных ганглиев позволит растормаживать таламус и, таким образом, открыть ворота.
Запуск потенциала действия и, следовательно, высвобождение нейротрансмиттеров происходит с помощью этого стробирующего механизма. В синаптическом стробировании, чтобы возник потенциал действия, должно быть более одного входа, чтобы произвести единственный выход в стробируемом нейроне. Взаимодействие между этими наборами нейронов создает биологическое логический элемент. Управляемый нейрон является бистабильным и должен быть приведен в рабочее состояние, прежде чем он сможет запустить потенциал действия. Когда этот бистабильный нейрон находится в активном состоянии, ворота открыты. Нейрон-привратник отвечает за стимуляцию бистабильного нейрона, переводя его из нижнего состояния в активное и, таким образом, открывая ворота. Как только ворота открыты, возбуждающий нейрон может вызвать дальнейшую деполяризацию бистабильного нейрона и достичь порогового значения, вызывающего возникновение потенциала действия. Если привратник не перемещает бистабильный нейрон снизу вверх, возбуждающий нейрон не сможет запустить потенциал действия в бистабильном нейроне. И нейрон-привратник, и возбуждающий нейрон необходимы для запуска потенциала действия в бистабильном нейроне, но ни того, ни другого недостаточно, чтобы сделать это в одиночку.
Пример этого типа гейтирования может происходить в прилежащем ядре. Исследования показали, что нейроны гиппокампа могут блокировать передачу сигналов между префронтальной корой и прилежащим ядром. Стимуляция нейронов префронтальной коры имеет очень небольшой шанс вызвать потенциал действия в прилежащем ядре, пока эти нейроны находятся в неактивном состоянии. Точно так же стимуляция нейронов гиппокампа не вызывает потенциалов действия в прилежащем ядре; однако было показано, что эти нейроны гиппокампа переключают свои мишени в прилежащем ядре в рабочее состояние. Пока эти нейроны остаются в активном состоянии, стимуляция префронтальных кортикальных нейронов имеет гораздо более высокую вероятность создания потенциалов действия в прилежащем ядре. Таким образом, гиппокамп служит привратником для потока информации от префронтальной коры к прилежащему ядру, так что его действие разрешает эти синапсы.
Синаптическое стробирование включает в себя множество механизмов, с помощью которых модулируется эффективность нейрональной активности. Дополнительные исследования демонстрируют разрешающие свойства синаптического гейтирования. В некоторых случаях деполяризация мембраны вызывает открытие ворот, которые ранее оказывали тормозящее действие на нейрон, который они блокировали. Однако это разрешающее стробирование - это больше, чем просто суммирование. Суммирование - это конвергенция многих ВПСП на бугорке аксона (либо от одного нейрона, активируемого с высокой частотой, либо от множества нейронов, активируемых одновременно), которое деполяризует мембранный потенциал до точки порога. Деполяризация мембраны, вызванная открытием синаптических ворот, вызывает дополнительное увеличение внутриклеточного кальция, что способствует высвобождению нейромедиаторов; таким образом, он способен избирательно распределять информацию от пресинаптической клетки.
Исследования детей с диагнозом СДВГ показали значительно более высокие баллы по шкале тревожности / депрессии Контрольного списка поведения детей Ахенбаха, что подразумевает наличие сопутствующей патологии СДВГ и тревожности. Было высказано предположение, что нарушение синаптических процессов в прилежащем ядре является основной причиной этой сопутствующей патологии. Этот дефект вызывает снижение синаптического гейтирования поступления дофамина из префронтальной коры и гиппокампа в прилежащее ядро. Одна теория предполагает, что этот дефект снижает способность человека выборочно подавлять реакции страха со стороны миндалины, что приводит к тревоге. Однако существует несколько теорий о том, как это нарушение в конечном итоге влияет на людей с СДВГ.
В исследованиях на грызунах префронтальная кора, в частности медиальная префронтальная кора (mPFC), участвовала в обработке информации длительностью от миллисекунд до нескольких секунд, в то время как гиппокамп участвовал в обработке информации в более длительных временных масштабах, например минуты в часы. Повреждение обеих этих областей у людей с СДВГ, кажется, иллюстрирует, почему они проявляют невнимательность и импульсивность. Нейроны Nucleus accumbens бистабильны и, таким образом, могут избирательно входить либо в «верхнее» - деполяризованное состояние, либо в «нижнее» - гиперполяризованное состояние. Нейроны Nucleus accumbens управляются входом из гиппокампа и миндалины, и это создает деполяризованный нейрон прилежащего ядра, который более восприимчив к иннервации, исходящей от префронтальной коры. Таким образом, у пациентов с СДВГ снижается не только вход от префронтальной коры к прилежащему ядру, но, кроме того, снижается входной сигнал от гиппокампа к прилежащему ядру, что приводит к снижению активации нейронов прилежащего ядра. Люди, принимающие такие лекарства, как метилфенидат (риталин), увеличивают выработку дофамина (DA) во многих из этих синапсов, помогая компенсировать потерю синаптической активности, вызванную патофизиологией СДВГ. Прием метилфенидата может увеличить проекцию DA в прилежащее ядро, что может не только увеличивать синаптическую активность между префронтальной корой и гиппокампом (улучшая память), но также действовать как система вознаграждения, поскольку прилежащее ядро является частью мезолимбического пути. Более того, возможно, именно поэтому люди, принимающие риталин, испытывают «потребность» и «желание» учиться, поскольку он действует как положительное подкрепление для мозга. Кроме того, активация схемы вознаграждения, скорее всего, является причиной того, что метилфенидат вызывает сильное привыкание и большую зависимость. В заключение, синаптическое стробирование иллюстрирует вероятный механизм, с помощью которого лекарства от СДВГ, такие как риталин, модулируют синаптическую активность и память.
Люди, страдающие шизофренией, часто демонстрируют неспособность иллюстрировать контекстно-зависимую память, неспособность показать аффективную валентность - правильные эмоции и неспособность к процессам внимания и времени. Синаптическое стробирование, кажется, иллюстрирует, почему развиваются все эти неспособности. В частности, вход гиппокампа в прилежащее ядро, область базальных ганглиев, действует как ворота, создавая более деполяризованное состояние в прилежащих нейронах, позволяя им быть более восприимчивыми к иннервации префронтальной коры (ПФК). Кроме того, вход миндалевидного тела во многом аналогичным образом действует как ворота, создавая более деполяризованное состояние в прилежащих нейронах, хотя это деполяризованное состояние является гораздо более временным. В целом нейроны прилежащего ядра бистабильны. Люди с шизофренией имеют повреждение гиппокампа и миндалины, что свидетельствует о неправильном гейтинге и приводит к тому, что нейроны прилежащего ядра находятся в нижнем положении. Вот почему люди с шизофренией демонстрируют неспособность к контекстно-зависимой памяти и их неспособность проявлять надлежащую аффективную валентность. Кроме того, поскольку прилежащие нейроны находятся в нижнем положении, они не так восприимчивы к стимуляции PFC, и поэтому у людей с шизофренией наблюдаются проблемы с дефицитом внимания. Теория стробирования шизофрении постулирует бистабильный нейрон прилежащего ядра, который при неправильном стробировании приводит к множеству нарушений поведения и памяти.
Текущие исследования пролили свет на тот факт, что бистабильность нейрона может быть частью более крупной бистабильной нейронной сети. Доказательства бистабильной сети были продемонстрированы на интернейронах слуховой коры. Стабильные состояния этой слуховой сети коры являются синхронными или антисинхронными, что иллюстрирует ее бистабильную природу. Когда слуховые интернейроны были соединены с электрическими и химическими тормозными синапсами, наблюдалась бимодальная картина возбуждения. Этот бимодальный шаблон иллюстрирует бистабильность сети для запуска в синхронном или антисинхронном состоянии. Эти два состояния могут быть режимами, с помощью которых человек воспринимает разные частоты в звуковых волнах. Будущие исследования направлены на выяснение того, воплощает ли эта бистабильная сеть многие свойства бистабильного нейрона, и есть ли более крупный привратник, модулирующий сеть в целом.
Было показано, что нейроны прилежащего ядра способны стробироваться, потому что они бистабильны. Недавние данные показали, что нейроны коры головного мозга также бистабильны и, следовательно, также могут быть закрыты. Похоже, что существует три различных типа стробирующих цепей: один контролируется корой, другой контролируется ассоциативными ядрами в таламусе, а третий контролируется цепями, охватывающими базальные ганглии, кору и таламус. Имеются убедительные доказательства того, что выход из таламуса влияет на реакцию префронтальной коры со стороны гиппокампа. Это рассматривается как усиление или подавление, иллюстрирующее бистабильность процесса. Было доказано, что нейроны прилежащего ядра действуют как ворота, но действуют ли нейроны коры таким же образом? В будущих исследованиях будут рассмотрены сходства между двумя наборами бистабильных нейронов. Кроме того, необходимо расширить механизм перевода бистабильных нейронов в их «нижнее» состояние. Это состояние ведет к ингибированию, и, следовательно, их тормозящие интернейроны модулируют этот сдвиг, и если да, то участвуют ли тормозящие нейротрансмиттеры, такие как ГАМК ? Наконец, нейроны, способные модулировать ворота, такие как нейроны гиппокампа и таламуса, могут контактировать со многими различными областями мозга. По мере увеличения количества исследований, утверждающих, что нейроны в коре, прилежащем ядре и мозжечке могут быть заблокированы, может ли гиппокамп модулировать сигналы для всего этого, и если да, может ли он соединить эти различные области мозга в гораздо большую нейронную сеть, способную модулируются сразу? Это вопросы, лежащие в основе синаптического стробирования в будущем.