 | |
| Имена | |
|---|---|
| Название IUPAC Динатрий фосфорфторидат | |
| Другие названия Натрия фторфосфат, динатрий монофторфосфат | |
| Идентификаторы | |
| Номер CAS | |
| 3D модель (JSmol ) | |
| ChEBI | |
| ChEMBL |
|
| ChemSpider | |
| ECHA InfoCard | 100.030.381 |
| EC Num ber |
|
| PubChem CID | |
| номер RTECS |
|
| UNII | |
| CompTox Dashboard ( EPA ) | |
InChI
| |
УЛЫБКА
| |
| Свойства | |
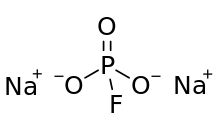
| Химическая формула | Na2PFO 3 |
| Молярная масса | 143,95 г / моль |
| Внешний вид | белый порошок |
| Плавление точка | 625 ° C (1157 ° F; 898 K) |
| Растворимость в воде | 25 г / 100 мл |
| Растворимость | не растворим в этаноле, эфире |
| Фармакология | |
| код АТС | A01AA02 (ВОЗ ) A12CD02 (ВОЗ ) |
| Опасности | |
| Паспорт безопасности | Sigma-Aldrich |
| NFPA 704 (огненный алмаз) |  0 2 1 0 2 1 |
| Температура вспышки | Невоспламеняющийся |
| Смертельная доза или концентрация (LD, LC): | |
| LD50(средняя доза ) | 502 мг / кг (крыса, перорально) |
| Если не указано иное, данные приведены для материалов в их стандартном состоянии (при 25 ° C [77 ° F], 100 кПа). | |
| Ссылки в ink | |
Монофторфосфат натрия, обычно сокращенно MFP, представляет собой неорганическое соединение с химической формулой Na2PO3F. Типично для соль, MFP не имеет запаха, бесцветен и водорастворим. Эта соль является ингредиентом некоторых зубных паст.
МФП наиболее известен как ингредиент некоторых зубных паст. Он действует как источник фторида посредством следующей реакции гидролиза :
Фторид защищает зубную эмаль от нападение бактерий, вызывающих кариес зубов (кариес). Хотя он был разработан химиком из Procter and Gamble, его использование в зубной пасте (зубная паста Colgate и Ultra Brite ) было запатентовано Colgate-Palmolive, поскольку компания Procter and Gamble занималась маркетингом зубной пасты Crest (содержащей фторид олова, продаваемой как «Флюористан»). В начале 1980-х Crest был переработан для использования MFP под торговой маркой «Fluoristat»; Сегодня в зубных пастах Crest используется фторид натрия или фторид олова. По сравнению с чистыми фторидами, монофторфосфат натрия имеет немного меньшее послевкусие.
MFP также используется в некоторых лекарствах для лечения остеопороза.
В 1991 году Калгон обнаружил, что монофторфосфат натрия ингибирует растворение свинца <17.>в питьевой воде при использовании в концентрациях от 0,1 мг / л до 500 мг / л.
Разрушение зубов вызывается бактериями, естественно присутствующими во рту. Эти бактерии образуют на зубах липкую бесцветную мягкую пленку, называемую зубным налетом. Когда едят продукты, содержащие углеводы (крахмалы и сахара ), бактерии, образующие зубной налет, используют сахар как форму энергии. Они также превращают его в клейкое вещество, которое помогает им прилипать к поверхности зуба. Зубной налет производит кислоту, которая разрушает эмаль.
Эмаль зубов состоит в основном из гидроксифосфата кальция, Ca 5 (PO 4)3ОН, также известный как минерал гидроксиапатит. Апатит - твердое, нерастворимое соединение. Кислота (H), образующаяся особенно после еды с высоким содержанием сахара, разрушает апатит:
Разложение апатита за счет потери ОН вызывает растворение эмали. Этот процесс обратим, поскольку слюна возвращает ОН для преобразования апатита. Если в слюне присутствуют ионы фторида, F, фторапатит, Ca 5 (PO 4)3F, также образует.
Фторапатит противостоит воздействию кислот лучше, чем сам апатит, поэтому зубная эмаль противостоит разложению лучше, чем эмаль, не содержащая фтора.
Монофторфос натрия фат получают промышленным путем реакцией фторида натрия с метафосфатом натрия :
. Процесс включает разрыв пирофосфатной связи, аналогичный гидролизу. NaMFP также можно получить путем обработки тетранатрийпирофосфата или динатрийфосфата фтористым водородом.
В лаборатории MFP можно получить путем гидролиза дифторфосфат-ионов с разбавленным гидроксидом натрия :
Структура фторфосфат-аниона состоит из фосфора в центре тетраэдра, образованного тремя атомами кислорода и одним фтором. Формальные представления изображают двойную связь между одним атомом кислорода и фосфора, с одинарными связями для двух других атомов кислорода и фтора. На этом очень формальном изображении отрицательный заряд локализован на атомах O одинарных связей P-O. MFP аналогичен и изоэлектронному с Na 2SO4. Анион имеет симметрию C 3v.
Монофторфосфат натрия был впервые описан в 1929 году немецким химиком, который тогда работал в Берлинском университете. Его бесплодные попытки получить свободную монофторфосфорную кислоту заставили его проверить стабильность ее эфиров. Вместе с одним из его учеников, Ланге синтезировал таким образом некоторые аналоги, которые оказались весьма токсичными и относились к нервно-паралитическим веществам. В 1930-е годы Герхард Шрадер, работая в немецкой компании IG Farben, пытался разработать синтетический инсектицид. Его работа была сосредоточена на сложных эфирах фосфорной кислоты и привела к случайному открытию некоторых других нервно-паралитических агентов, таких как DFP (диизопропилфторфосфат ), Табун, Зоман и Зарин. Тем временем Ланге, который был женат на еврейке, эмигрировал из Германии в США и начал работать в компании Procter and Gamble. В 1947 году он и Ральф Ливингстон из Monsanto Company опубликовали препарат свободных фторфосфорных кислот и упомянули об использовании некоторых токсичных эфиров монофторфосфорной кислоты (например, DFP) для лечения глаукомы и миастения. Хорошо известная токсичность этих сложных эфиров вызвала опасения, что простые соли также могут быть токсичными, и такие опасения исключали любое крупномасштабное коммерческое использование солей. В 1950 году при спонсорской поддержке производителя соединений токсичность монофторфосфата натрия была изучена Гарольдом Ходжем в Университете Рочестера, который включал в себя тестирование против кариеса. В 1967 году Colgate-Palmolive подала несколько патентов на использование монофторфосфата натрия в зубной пасте.
Обычное содержание MFP в зубной пасте составляет 0,76%. Это соединение используется вместо фторида натрия, особенно в детских зубных пастах, потому что оно менее токсично, хотя оба обладают умеренной токсичностью. LD50 у крыс составляет 0,9 г / кг.