| Синдром Смита - Лемли - Опица | |
|---|---|
| Другие названия | SLOS или Дефицит 7-дегидрохолестерин редуктазы |
 | |
| 7-дегидрохолестерин - токсичный стероидный метаболит, который накапливается в организме людей с SLOS | |
| Специальность | Медицинская генетика |
Синдром Смита-Лемли-Опица врожденная ошибка синтез холестерина. Это аутосомный рецессивный синдром множественных пороков развития, вызванный мутацией в ферменте 7-дегидрохолестеринредуктазе кодируется геном DHCR7. Он предлагает широкий спектр возможностей от легкой умственной отсталости и поведенческих проблем до смертельных пороков развития.
SLOS может проявить себя по-разному в разных случаях, в зависимости от тяжести мутации и других факторов. Первоначально пациенты с SLOS были разделены на две категории (классические и тяжелые) на физических и психических характеристиках. С момента определения специфического биохимического дефекта, ответственного за SLOS, пациента присваивается оценка степени тяжести, основанная на их уровнях церебральных, оральных и генитальных дефектов. Затем он используется для классификации пациентов с легкой, классической или тяжелой SLOS.
Наиболее распространенные черты лица SLOS включают микроцефалию, битемпоральное сужение (уменьшенное расстояние между висками), птоз, короткий и вздернутый нос, микрогнатия, эпикантальные складки и капиллярная гемангиома носа. Другие физические характеристики включают:
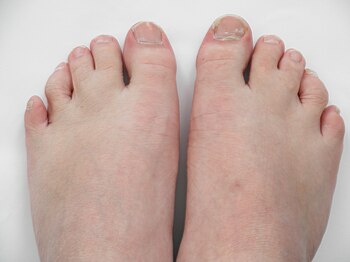 Синдактилия и второго третьего пальцев стопы
Синдактилия и второго третьего пальцев стопы Определенные поведение и атрибуты являются обычными имеющимися среди пациентов, страдающих SLOS. Они могут иметь низкий нормальный интеллект и реагировать негативно или гиперчувствительно на различные сенсорные стимулы. Это особенно верно для определенных слуховых и зрительных стимулов. Многие пациенты проявляют агрессивность и самоповреждающее поведение, часто возникают нарушения сна. Часто наблюдается специфическое поведение, напоминающее поведение людей с аутизмом, а также гиперактивность, что дает генетическое и биологическое понимание расстройств аутистического вида. Наиболее характерными для пациентов с SLOS аутическими формами поведения являются опистокинез (движение верхней части тела), растяжение верхней части тела и взмахи руками. Аутизм обычно диагностируется отдельно от SLOS с помощью DSM-V, и примерно 50–75% пациентов SLOS соответствуют критериям аутизма.
Другое поведение, связанное с SLOS, может быть связано с отклонением. Например, у младенцев часто наблюдаются проблемы с кормлением или непереносимость кормления, а пациентам может потребоваться повышенное потребление калорий из-за ускоренного метаболизма. Рецидивирующие инфекции, включая инфекцию уха и пневмонию, также распространены.
Учитывая, что SLOS вызывается мутацией фермента, участвующего в синтезе холестерина, полученные биологические характеристики можно предсказать.. У потенциально снижен уровень холестерина в плазме (гипохолестеринемия ). Однако примерно 10% могут показывать нормальный уровень холестерина, улучшенные концентрации холестерина не являются единственным показателем SLOS. Повышенные уровни предшественников холестерина также распространены при SLOS. В частности, повышенные уровни 7-дегидрохолестерина довольно специфичны для SLOS.
Ген, кодирующий DHCR7 (обозначенный как DHCR7) был клонирован в 1998 году и был картирован на хромосоме 11q12- 13. Это 14100 пар оснований ДНК в длине и содержит девять экзонов, соответствующая мРНК имеет длину 2786 пар оснований (оставшаяся последовательность ДНК является интронной). Структура гена крысы DHCR7 очень похожа на структуру гена человека.
Самые высокие уровни экспрессии DHCR7 были обнаружены в надпочечниках, семенниках, печени и в мозговой ткани. Его экспрессия индуцируется уменьшением концентраций стерола посредством белков, регулирующих связывание стерола (SREBP). Есть также свидетельства того, что его активность может регулироваться тканеспецифической транскрипцией и альтернативным сплайсингом.
Как указано выше, фермент DHCR7 катализирует восстановление 7DHC до холестерина, а также восстановление 7-дегидродесмостерола до десмостерола.. Он НАДФН в качестве кофактора для этого восстановления требует активности оксидоредуктазы цитохром-P450. Также считается, что он содержит железо. DHCR7 представляет собой интегральный мембранный белок эндоплазматического ретикулума, и компьютерные модели предсказали до девяти трансмембранных доменов. DHCR7 наиболее эффективен при восстановлении 7DHC, но известно, что он восстанавливает двойную связь углерода 7 других стеролов, что указывает на диапазон субстратной специфичности. Предполагается, что человеческая версия этого фермента молекулярную массу 54,489 кДа и изоэлектрическую точку 9,05.
Предполагается, что последовательность 279>аминокислот, которая кодирует DHCR7, содержит 475 аминокислот, а также несколько белковых мотивов. Он содержит несколько мотивов стеролредуктазы, как и ожидатьало его функции. Он потенциальный стерол-чувствительный домен (SSD), функция которого неизвестна, но считается для связывания стероловых субстратов. Он также включает несколько сайтов фосфорилирования, потенциальные сайты протеинкиназы C и тирозинкиназы (регуляторные ферменты, ответственные за фосфорилирование). Точная функция фосфорилирования DHCR7 пока неизвестна, но, что он участвует в регуляции его активности.
 Миссенс-мутации составляют 87,6% по SLOS
Миссенс-мутации составляют 87,6% по SLOS SLOS является аутосомным рецессивным заболеванием. Было идентифицировано более 130 различных типов мутаций. Миссенс-мутации (изменение одного нуклеотида, приводящее к кодированию другой аминокислоты) являются наиболее распространенными, составляющими 87,6% SLOS. Обычно они снижают функцию фермента, но не могут полностью ее подавить. Многое зависит от характера мутации (т.е. какая аминокислота заменяется и где). Нулевые мутации встречаются реже, либо полностью дисфункциональный фермент, либо вообще не фермент. Таким образом, миссенс-мутации могут быть распространенными в целом, потому что они менее смертельны, чем бессмысленные мутации; бессмысленные мутации могут просто привести к самопроизвольному выкидышу.
Мутация IVS8-1G>C является наиболее часто регистрируемой мутацией в DHCR7. Это нарушает соединение восьмого и девятого экзонов и приводит к вставке 134 нуклеотидов в транскрипт DHCR7. Это бессмысленная мутация, поэтому пациенты, которые гомозиготны по этому аллелю, серьезно страдают. Считается, что эта мутация впервые произошла на Британских островах, и у нее носитель (те, которые гетерозиготны по аллелю, но не затронуты). 1,09% для кавказцев европейского происхождения. Частота мутаций различается для разных национальностей в зависимости от происхождения мутации. Во всех европейских популяциях эта мутация имеет предполагаемую частоту носительства 3%.
Следующая наиболее распространенная мутация - 278C>T, и приводит к треонину в позиции 93 аминокислоты. Это миссенс-мутация, которая, как правило, работает с менее серьезными симптомами. Эта мутация является наиболее часто встречающейся у пациентов итальянского, кубинского и средиземноморского происхождения.
Третья по частот мутации - 452G>A. Эта бессмысленная мутация вызывает терминацию белка, так что фермент DHCR7 не образуется. Считается, что она возникла в Южной Польше и наиболее распространена в Северной Европе.
Другие мутации менее распространены, хотя, по-видимому, нацелены на черные белковые домены больше, чем на другие. Например, мотивы стеролредуктазы являются общими сайтами мутации. В целом, согласно оценкам, частота носительства (для любой мутации DHCR7, вызывающей SLOS) составляет 3-4% в популяциях европеоидов (реже среди азиатских и африканских популяций). Это число указывает на гипотетическое рождение заболеваемость между 1/2500 и 1/4500. Однако измеренная заболеваемость составляет от 1/10 000 до 1/60 000 (это зависит от происхождения и происхождения). Это намного меньше, чем ожидалось. Это указывает на то, что многие случаи SLOS не обнаруживаются и, вероятно, связаны либо с самопроизвольным абортом, вызванным тяжелыми мутациями (выкидышем), либо с легкими случаями, которые не диагностируются. У женщин отсутствуют характерные пороки развития половых органов, характерные для мужчин, и поэтому их вероятность правильного диагноза снижается.
Холестерин можно получить через диета, но она также может быть сформирована метаболизмом в организме. Метаболизм холестерина в основном происходит в печени, а также в кишечнике. Следует также отметить, что холестерин не может пройти через гематоэнцефалический барьер, поэтому в мозге биосинтез является единственным средством холестерина.
 Мевалонатный путь.
Мевалонатный путь. У людей холестерин синтез начинается с мевалонатного пути (см. Диаграмму), что приводит к синтезу фарнезилпирофосфата (FPP). В этом пути используются два ацетил-КоА и два НАДФН для получения мевалоната, который метаболизируется до изопентенилпирофосфата (IPP) с использованием трех СПС. Отсюда необходимо три IPP для создания одного FPP. Комбинация двух FPP приводит к образованию сквал ; это представляет собой первый серьезный шаг к биосинтезу холестерина. Сквален приводит к образованию ланостерина, из которого существует множество путей, ведущих к биосинтезу холестерина. Ограничивающая скорость стадия превращения холестерина - это превращение 3-гидрокси-3-метилглутарил-CoA (HMG-CoA) в мевалонат, это ранняя стадия мевалонатного пути, катализируемая HMG- КоА-редуктаза.
 Схема реакции сквалена с получением ланостерина.
Схема реакции сквалена с получением ланостерина.  Множественные пути, ведущие к холестерину из ланостерина, включая путь Кандуч-Рассела. Красным выделена двойная связь, которая восстанавливается ферментом DHCR7.
Множественные пути, ведущие к холестерину из ланостерина, включая путь Кандуч-Рассела. Красным выделена двойная связь, которая восстанавливается ферментом DHCR7. Путем сложной серии методов ланостерин приводит к образованию зимостерина. Как показано на диаграмме справа, именно в этой точке путь расходится. У людей путь основной, ведущий к холестерину, известен как путь Кандуч-Рассела. Зимостерин метаболизируется до 5α-холеста-7,24-диен-3β-ол, затем до латостерола, а затем до 7-дегидрохолестерина или 7-DHC. 7-DHC является непосредственным предшественником холестерин, а фермент DHCR7 отвечает за превращение 7-DHC в холестерин. DHCR7 восстанавливает двойную связь на углероде 7 7-DHC, приводя к неэтерифицированному продукту. Мутации в этом ферменте ответственны за широкий спектр дефектов, присутствующих в SLOS. В другом пути, ведущим к синтезуестерина, DHCR7 необходим для восстановления 7-дегидродесмостерола до десмостерола.
Регуляция синтез холестерина сложна и происходит в основном через фермент HMG-CoA редуктаза (катализатор лимитирующей стадии). Он включает петлю обратной связи, которая чувствительна к клеточным уровням холестерина. Четыре основных этапа регуляции :
Холестерин - важный липид, участвующий в метаболизме, функциях и структуре клеток. Он является структурным компонентом клеточной мембраны, так что он образует и регулирует текучесть фосфолипидного бислоя. Кроме того, холестерин является составной частью липидных рафтов. Это скопления белков и липидов (включая сфинголипиды и холестерин), которые плавают внутри клеточной мембраны и играют роль в регуляции функций мембраны. Липидные рафты более упорядочены или жестки, чем окружающий их мембранный бислой. Их участие в регуляции происходит главным образом из их ассоциации с белками; при связывании субстратов некоторые белки высоким сродством к прикреплению к липидным рафтам. Это сближает их с другими белками, что позволяет им влиять на сигнальные пути. Холестерин, в частности, действует как спейсер и клей для липидных рафтов; отсутствие холестерина приводит к диссоциации белков.
Егопреобладание в клеточных мембранах, холестерин принимает активное участие в определенных транспортных процессах. Это может влиять на функцию ионных каналов и других мембранных транспортеров. Например, холестерин необходим для связывающей активности лиганда рецептора серотонина рецептора. Кроме того, это, по-видимому, очень важно в экзоцитозе. Холестерин модулирует свойства мембраны (такие как кривизна мембраны) и может регулировать влияние везикул с клеточной мембраной. Это также может привести к привлечению комплексов, экзоцитоза. Учитывая, что нейроны в степени зависят от экзоцитоза для передачи импульсов, холестерин является очень важной функцией нервной системы.
 и производных холестерина.
и производных холестерина. Одним из особенно важных путей, по которому происходит холестерин, является сигнальный путь Hedgehog. Этот путь очень важен во время эмбрионального развития и участвует в решении судьбы клеток (то есть в какую ткань им необходимо мигрировать). Белки Hedgehog также участвуют в транскрипции генов, регулирующих пролиферацию и дифференцировку клеток. Холестерин важен для этого пути, потому что он подвергается ковалентному связыванию с белками Hedgehog, что приводит к их активации. Без холестерина активность передачи сигналов нарушается, дифференцировка клеток может нарушена.
Холестерин является предшественником многих важных молекул. К ним относятся желчные кислоты (важные для пищевых продуктов), оксистерины, нейростероиды (участвующие в нейротрансмиссии и возбуждении), глюкокортикоиды ( участвующие в при иммунных и воспалительных процессах), минералокортикоидов (осмотический баланс) и половых стероидов (т.е. эстроген и тестостерон ; широкий диапазон функций но вовлечены в генитальное развитие пренатально). Наконец, холестерин является основным компонентом миелина, защитным слоем вокруг нейронов. Миелинизация наиболее быстро во время пренатального развития, а это означает, что потребность в биосинтезеестерина очень высока.
Учитывая, что функция охватывает очень широкий диапазон холестерина, маловероятно, что симптомы SLOS связаны с одним молекулярным механизмом. Некоторые из молекулярных эффектов пока неизвестны, но могут быть экстраполированы на основе роли холестерина. Как правило, отрицательные эффекты обусловлены пониженным уровнем холестерина и повышенным уровнем предшественников холестерина, в первую очередь, 7DHC. Хотя 7DHC структурно похож на холестерин и потенциально может действовать как заменитель, его эффекты все еще изучаются.
У большинства пациентов с SLOS наблюдается снижение уровня холестерина, особенно в головном мозге (где уровень холестерина зависит в первую очередь от холестерина). по новому синтезу). Это также означает, что любые стериновые производные холестерина также будут иметь пониженные концентрации. Например, в SLOS можно увидеть пониженные уровни. Это липиды, которые участвуют в передаче сигналов в головном мозге и должны вырабатываться в самом мозгу. Они отвечают за взаимодействие с ядерными стероидными рецепторами и связываются с медиаторными -зависимыми ионными каналами. В частности, они модулируют эффекты рецепторов ГАМК и NMDA, что приводит к успокаивающим эффектам, улучшению памяти и многому другому. Таким образом, учитывая, что некоторые характеристики SLOS противоположны этим эффектам (гиперактивность, тревожность), снижение нейростероидов может повлиять как на неврологическое развитие, так и на поведение.
 Патогенез синдрома Смита-Лемли-Оптиза.
Патогенез синдрома Смита-Лемли-Оптиза. Кроме того, как Как указано выше, холестерин является важным аспектом передачи сигналов Hedgehog. При более низком уровне холестерина хэджхог белки не будут подвергаться необходимой ковалентной модификации и последующей активации. Это может привести к нарушению эмбрионального развития и может способствовать наблюдаемым физическим врожденным дефектам при SLOS. Один конкретный сигнальный белок хэджхог, sonic hedgehog (SHH), важен в структуре центральной нервной системы, чертах лица и конечностях. Другие белки hedghehog могут участвовать в развитии половых путей и скелеона.
Измененные уровни стеролов в SLOS особенно важны для клеточных мембран, которые состоят в основном из липидов. У пациентов с SLOS могут проявляться клеточные мембраны с аномальными свойствами или составом, а пониженный уровень холестерина сильно влияет на стабильность и белки липидных рафтов. Несмотря на их структурное сходство, 7DHC не может заменить холестерин в липидных рафтах. Кроме того, недостаток холестерина способствует повышенной текучести клеточной мембраны и может вызвать аномальную секрецию гранул. Все эти изменения в мембране, вероятно, вносят вклад в изменения транспортных функций, которые наблюдаются при SLOS. Они могут вызывать