Малые ядрышковые РНК (мяРНК ) представляют собой класс малых молекулы РНК, которые в первую очередь направляют химические модификации других РНК, в основном рибосомных РНК, транспортных РНК и малых ядерных РНК. Существует два основных класса snoRNA: c / D-бокс-snoRNA, которые связаны с метилированием, и H / ACA-box snoRNA, которые связаны с псевдоуридилированием. SnoRNA обычно называют направляющими РНК, но их не следует путать с направляющими РНК, которые направляют в трипаносомы.
После транскрипции возникающие молекулы рРНК (так называемые пре-рРНК) подвергаются серия этапов обработки для создания зрелой молекулы рРНК. Перед расщеплением экзо- и эндонуклеазами пре-рРНК претерпевает сложный паттерн нуклеозидных модификаций. К ним относятся метилирование и псевдоуридилирование, управляемое snoRNA.
Каждая молекула мяРНК действует как ориентир только для одной (или двух) индивидуальных модификаций в целевой РНК. Чтобы осуществить модификацию, каждая мяРНК связывается по меньшей мере с четырьмя коровыми белками в комплексе РНК / белок, называемом небольшой ядрышковой рибонуклеопротеидной частицей (snoRNP). Белки, связанные с каждой РНК, зависят от типа молекулы snoRNA (см. Руководства по семействам snoRNA ниже). Молекула мяРНК содержит антисмысловой элемент (отрезок из 10-20 нуклеотидов ), который является основанием, комплементарным последовательности, окружающей основание (нуклеотид ), предназначенное для модификация в молекуле пре-РНК. Это позволяет snoRNP распознавать РНК-мишень и связываться с ней. После связывания snoRNP с сайтом-мишенью соответствующие белки находятся в правильном физическом положении, чтобы катализировать химическую модификацию основания-мишени.
Два разных типа модификации рРНК (метилирование и псевдоуридилирование) управляются двумя разными семействами мяРНК. Эти семейства snoRNA называются антисмысловыми C / D box и H / ACA box snoRNA на основании присутствия консервативных мотивов последовательности в snoRNA. Есть исключения, но, как правило, члены коробки C / D руководят метилированием, а члены H / ACA руководят псевдоуридилированием. Члены каждой семьи могут различаться по биогенезу, структуре и функциям, но каждая семья классифицируется по следующим обобщенным характеристикам. Подробнее см. Обзор. SnoRNA классифицируются как малые ядерные РНК в MeSH. HGNC в сотрудничестве с snoRNABase и экспертами в этой области утвердили уникальные имена для генов человека, кодирующих snoRNA.
 Пример вторичной структуры мяРНК C / D-бокса, взятой из базы данных Rfam. Этот пример: SNORD73 (RF00071).
Пример вторичной структуры мяРНК C / D-бокса, взятой из базы данных Rfam. Этот пример: SNORD73 (RF00071). C / D box snoRNA содержат два коротких консервативных мотива последовательности, C (RUGAUGA) и D (CUGA), расположенные рядом с 5 ' и 3 ' концы мяРНК соответственно. Короткие области (~ 5 нуклеотидов), расположенные выше от C-бокса и ниже от D-бокса, обычно комплементарны по основанию и образуют структуру стержневого бокса, которая приносит C- и D-боксы. мотивы в непосредственной близости. Эта структура стволовых коробок, как было показано, важна для правильного синтеза snoRNA и локализации ядрышка. Многие C / D-бокс-snoRNA также содержат дополнительную менее хорошо консервативную копию мотивов C и D (обозначаемых как C 'и D'), расположенную в центральной части молекулы snoRNA. Консервативная область длиной 10–21 нуклеотидов выше D-бокса комплементарна сайту метилирования целевой РНК и позволяет snoRNA образовывать дуплекс РНК с РНК. Нуклеотид, который должен быть модифицирован в целевой РНК, обычно располагается в 5-м положении выше D-бокса (или D '-бокса). C / D box snoRNA связаны с четырьмя эволюционно консервативными и незаменимыми белками - фибрилларином (Nop1p), NOP56, NOP58 и Snu13 (белок 15,5 кДа у эукариот). ; его архейным гомологом является L7Ae), которые составляют сердцевину C / D-бокс-snoRNP.
Существует эукариотическая C / D-бокс-snoRNA (snoRNA U3 ), которая не была показана руководство по 2'-O-метилированию. Вместо этого он участвует в процессинге рРНК, управляя расщеплением пре-рРНК.
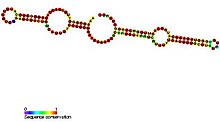 Пример вторичной структуры snoRNA блока H / ACA, взятый из базы данных Rfam. Этот пример: SNORA69 (RF00265).
Пример вторичной структуры snoRNA блока H / ACA, взятый из базы данных Rfam. Этот пример: SNORA69 (RF00265). H / ACA box snoRNA имеют общую вторичную структуру, состоящую из двух шпилек и двух однонитевых областей. называется структурой шпилька-шарнир-шпилька-хвост. H / ACA мяРНК также содержат консервативные мотивы последовательности, известные как H-бокс (консенсусная ANANNA) и ACA-бокс (ACA). Оба мотива обычно располагаются в одноцепочечных областях вторичной структуры. Мотив H расположен в шарнире, а мотив ACA расположен в области хвоста; 3 нуклеотида с 3'-конца последовательности. Области шпильки содержат внутренние выпуклости, известные как петли распознавания, в которых расположены антисмысловые направляющие последовательности (основания, комплементарные целевой последовательности). Эти направляющие последовательности по существу отмечают расположение уридина на целевой рРНК, которая будет модифицирована. Эта последовательность распознавания является двудольной (построена из двух разных плеч области петли) и образует сложные псевдузлы с целевой РНК. H / ACA box snoRNAs связаны с четырьмя эволюционно консервативными и незаменимыми белками - дискерином (Cbf5p), GAR1, NHP2, и которые составляют ядро Коробка H / ACA snoRNP. Дискерин, вероятно, является каталитическим компонентом комплекса рибонуклеопротеидов (РНП), поскольку он обладает несколькими консервативными последовательностями псевдоуридинсинтазы и тесно связан с псевдоуридинсинтазой, которая модифицирует уридин в тРНК. В низших эукариотических клетках, таких как трипаносомы, подобные РНК существуют в форме одиночной шпилечной структуры и бокса AGA вместо бокса ACA на 3'-конце РНК. Подобно трипаносомам, Entamoeba histolytica имеет смешанную популяцию как одиночных шпилек, так и мяноРНК H / ACA-бокса с двойной шпилькой. Сообщалось, что произошел процессинг snoRNA H / ACA-бокса с двойной шпилькой в одиночные snoRNA шпильки, однако, в отличие от трипаносом, он имеет регулярный мотив ACA на 3'-хвосте.
РНК-компонент человека теломераза (hTERC) содержит домен H / ACA для образования пре-РНП и ядрышковой локализации самой теломеразной РНП. H / ACA snoRNP был вовлечен в редкое генетическое заболевание врожденный дискератоз (DKC) из-за его аффилированности с теломеразой человека. Мутации белкового компонента snoRNP H / ACA приводят к снижению физиологических уровней TERC. Это сильно коррелировало с патологией, лежащей в основе DKC, которая, по-видимому, в первую очередь является болезнью плохого поддержания теломер.
Необычная направляющая snoRNA U85, которая действует как в метилировании 2'-O-рибозы, так и в псевдоуридилировании малой ядерной РНК ( snRNA) U5 был идентифицирован. Эта составная snoRNA содержит оба C / D- и H / ACA-бокса домены и ассоциирует с белками, специфичными для каждого класса snoRNA (fibrillarin и Gar1p, соответственно). В настоящее время охарактеризованы более сложные snoRNA.
Было обнаружено, что эти составные snoRNA накапливаются в субядерной органелле, называемой тельцом Кахаля, и упоминаются как малые специфичные для тельца Cajal РНК.. Это контрастирует с большинством мяРНК C / D-бокса или H / ACA-бокса, которые локализуются в ядрышке. Предполагается, что эти специфичные для тельца Кахаля РНК участвуют в модификации транскрибируемых РНК-полимеразой II сплайсосомных РНК U1, U2, U4, U5 и U12. Не все snoRNAs, которые были локализованы в тельцах Cajal, представляют собой составные c / D- и H / ACA-бокс-snoRNAs.
Мишени для вновь идентифицированных snoRNA предсказываются на основе комплементарности последовательностей между предполагаемыми целевыми РНК и антисмысловыми элементами или петлями узнавания в последовательности snoRNA. Однако появляется все больше «сиротских» гидов без каких-либо известных РНК-мишеней, что предполагает, что в рРНК может быть больше белков или транскриптов, чем раньше, и / или что некоторые мяРНК выполняют другие функции, не относящиеся к рРНК. Есть свидетельства того, что некоторые из этих орфанных snoRNAs регулируют транскрипты с альтернативным сплайсингом. Например, кажется, что C / D-бокс snoRNA SNORD115 регулирует альтернативный сплайсинг мРНК серотонинового рецептора 2C через консервативную область комплементарности. Другая C / D-бокс snoRNA, SNORD116, которая находится в том же кластере, что и SNORD115, с использованием биоинформатического подхода, как было предсказано, имеет 23 возможных мишени в генах, кодирующих белок. Было обнаружено, что большая часть из них подвергалась альтернативному сплайсингу, что свидетельствует о роли SNORD116 в регуляции альтернативного сплайсинга.
Точный эффект модификаций метилирования и псевдоуридилирования на функция зрелых РНК еще не известна. Модификации, по-видимому, не являются существенными, но известно, что они слегка усиливают укладку РНК и взаимодействие с рибосомными белками. В подтверждение их важности модификации сайта-мишени локализуются исключительно в консервативных и функционально важных доменах зрелой РНК и обычно консервативны среди отдаленных эукариот.
SnoRNA расположены в разных частях генома. Большинство генов мяРНК позвоночных кодируется в интронах генов, кодирующих белки, участвующие в синтезе или трансляции рибосом, и синтезируются РНК-полимеразой II. Также показано, что SnoRNA расположены в межгенных областях, ORF генов, кодирующих белок, и UTR. SnoRNA также могут быть транскрибированы со своих собственных промоторов с помощью РНК-полимеразы II или III.
В геноме человека есть по крайней мере два примера, где C / D box snoRNA находятся в тандеме. повторяется внутри отпечатанных локусов. Эти два локуса (14q32 на хромосоме 14 и 15q11q13 на хромосоме 15) были тщательно охарактеризованы, и в обоих регионах были обнаружены множественные snoRNAs, расположенные внутри интронов в кластерах близкородственных копий.
В 15q11q13 было идентифицировано пять различных snoРНК (SNORD64, SNORD107, SNORD108, SNORD109 (две копии), SNORD116 (29 копий) и SNORD115 (48 копий). Утрата 29 копий SNORD116 (HBII-85) из этого региона была идентифицирована как причина синдрома Прадера-Вилли, тогда как увеличение дополнительных копий SNORD115 было связано to аутизм.
Область 14q32 содержит повторы двух snoРНК SNORD113 (9 копий) и SNORD114 (31 копия) в интронах тканеспецифического транскрипта нкРНК (MEG8 Было показано, что домен 14q32 имеет общие геномные особенности с импринтированными локусами 15q11-q13, и была предложена возможная роль тандемных повторов C / D box snoRNA в эволюции или механизме импринтированных локусов.
snoRNA могут функционировать как miRNA. Было показано, что человеческий ACA45 представляет собой настоящую snoRNA, которая может быть преобразована в 21- нуклеотиды - длинная зрелая миРНК по R Эндорибонуклеаза семейства NAse III dicer. Этот продукт snoRNA ранее был идентифицирован как mmu-miR-1839, и было показано, что он процессируется независимо от другой miRNA-генерирующей эндорибонуклеазы дроша. Биоинформатический анализ показал, что предположительно происходящие от snoRNA, miRNA-подобные фрагменты встречаются в разных организмах.
Недавно было обнаружено, что snoRNA могут иметь функции, не связанные с рРНК. Одной из таких функций является регуляция альтернативного сплайсинга транскрипта трансгена, который осуществляется snoRNA HBII-52, также известной как SNORD115.
В ноябре 2012 года Schubert et al. выявили, что специфические РНК контролируют уплотнение и доступность хроматина в клетках дрозофилы.