| |||
| Имена | |||
|---|---|---|---|
| Предпочтительное название IUPAC 2-гидроксибензальдегид | |||
| Другие названия Салициловый альдегид. Салициловый альдегид. о-гидроксибензальдегид | |||
| Идентификаторы | |||
| Номер CAS | |||
| 3D-модель (JSmol ) | |||
| ChEBI | |||
| ChEMBL |
| ||
| ChemSpider | |||
| ECHA InfoCard | 100.001.783 | ||
| UNII | |||
| Dashboard>CompT (EPA ) | |||
InChI
| |||
УЛЫБКА
| |||
| Свойства | |||
| Химическая формула | C7H6O2 | ||
| Молярная масса | 122,123 г · моль | ||
| Плотность | 1,146 г / см | ||
| Точка плавления | −7 ° C (19 ° F; 266 K) | ||
| Точка кипения | от 196 до 197 ° C (От 385 до 387 ° F; От 469 до 470 K) | ||
| Магнитная восприимчивость (χ) | -64,4 · 10 см / моль | ||
| Опасности | |||
| Паспорт безопасности | |||
| Пиктограммы GHS |   | ||
| Сигнальное слово GHS | Предупреждение | ||
| Краткая характеристика опасности GHS | H302, H315, H317, H319, H335, H411 | ||
| Меры предосторожности GHS | P280, P305 + 351 + 338 | ||
| Родственные соединения | |||
| Родственные соединения | Салициловая кислота. Бензальдегид. Салицилальдоксим | ||
| Кроме если указано иное, данные приведены для материалов в их стандартном состоянии (при 25 ° C [77 ° F], 100 кПа). | |||
| Ссылки на ink | |||
Салициловый альдегид (2-гидроксибензальдегид) представляет собой органическое соединение с формулой C 6H4CHO-2-OH. Наряду с 3-гидроксибензальдегидом и 4-гидроксибензальдегидом, это один из трех изомеров гидроксибензальдегида. Эта бесцветная маслянистая жидкость при более высокой концентрации имеет запах горького миндаля. Салицилальдегид является ключевым предшественником различных хелатирующих агентов, некоторые из которых имеют коммерческое значение.
Салицилальдегид получают из фенола и хлороформ путем нагревания с гидроксидом натрия или гидроксидом калия в реакции Реймера – Тимана :

В качестве альтернативы его получают конденсацией фенола или его производных с формальдегидом с образованием гидроксибензилового спирта, который окисляется до альдегида.
Салицилальдегиды, как правило, могут быть получены из соответствующего фенола по реакции Даффа или обработкой параформальдегидом в присутствии хлорида магния
Салицилальдегид был идентифицирован как характерный ароматический компонент гречихи.
. Он также является одним из компонентов кастореума, экссудат касторовых мешочков зрелого североамериканского бобра (Castor canadensis ) и европейского бобра (Castor fiber ), используемый в парфюмерии.
Кроме того, салицилальдегид присутствует в личиночных защитных секретах нескольких листоедов видов, принадлежащих к подтрибе Chrysomelina. Примером вида листоеда, продуцирующего салицилальдегид, является листоед красный тополь Chrysomela populi.
Салицилальдегид используется для получения следующих веществ:
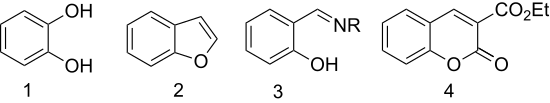 Катехол, бензофуран, салицилальдегидимин (R = алкил или арил), 3-карбэтоксикумарин
Катехол, бензофуран, салицилальдегидимин (R = алкил или арил), 3-карбэтоксикумарин