| Ротавирус | |
|---|---|
 | |
| Компьютерная реконструкция ротавируса на основе нескольких электронных микрофотографий | |
| Классификация вируса | |
| (без рейтинга): | Вирус |
| Область: | Рибовирия |
| Королевство: | Орторнавиры |
| Тип: | Duplornaviricota |
| Класс: | Резентовирицеты |
| Заказ: | Reovirales |
| Семейство: | Reoviridae |
| Подсемейство: | Sedoreovirinae |
| Род: | Rotavirus |
| Типовой вид | |
| Ротавирус A. | |
| Вид | |
| |
Ротавирус представляет собой род из двухцепочечной РНК вирусы из семейства Reoviridae. Ротавирусы являются наиболее частой причиной диарейных заболеваний среди младенцев и детей младшего возраста. Почти каждый ребенок в мире заражается ротавирусом хотя бы один раз к пятилетнему возрасту. Иммунитет развивается с каждой инфекцией, поэтому последующие инфекции менее серьезны; взрослые страдают редко. Существует десять видов этого рода, называемых A, B, C, D, E, F, G, H, I и J. Ротавирус A, наиболее распространенный вид, вызывает более 90% ротавирусных инфекций у человека.
Вирус передается фекально-оральным путем. Он заражает и повреждает клетки, которые выстилают тонкий кишечник, и вызывает гастроэнтерит (который часто называют «желудочным гриппом», несмотря на то, что он не имеет отношения к гриппу ). Хотя ротавирус был обнаружен в 1973 году Рут Бишоп и ее коллегами с помощью электронных микрофотографий и составляет примерно одну треть госпитализаций по поводу тяжелой диареи у младенцев и детей, его важность исторически недооценивалась общественностью . сообщество здравоохранения, особенно в развивающихся странах. Помимо воздействия на здоровье человека, ротавирус также поражает других животных и является патогеном домашнего скота.
Ротавирусный энтерит обычно легко поддается лечению детским заболеванием, но в 2013 году ротавирусы стал причиной 37 процентов смертей детей от диареи и 215 000 смертей во всем мире, и еще почти два миллиона серьезно заболели. Большинство этих смертей произошло в развивающихся странах. В Соединенных Штатах до начала программы ротавирусной вакцинации в 2000-х годах ротавирус вызывал около 2,7 миллиона случаев тяжелого гастроэнтерита у детей, почти 60 000 госпитализаций и около 37 смертей каждый год. После внедрения ротавирусной вакцины в США количество госпитализаций значительно упало. Кампании общественного здравоохранения по борьбе с ротавирусом сосредоточены на обеспечении пероральной регидратационной терапии для инфицированных детей и вакцинации для предотвращения заболевания. Заболеваемость и тяжесть ротавирусных инфекций значительно снизились в странах, которые включили ротавирусную вакцину в свою обычную политику иммунизации детей.
Существует десять видов ротавирусов, обозначаемых как A, B, C, D, E, F, G, H, I и J. Люди в первую очередь инфицированы ротавирусом вида A. Виды A – E вызывают заболевания у других животных, виды E и H - у свиней, D, F и G - у птиц, I - у кошек и J. я n летучих мышей. Внутри ротавируса А существуют разные штаммы, называемые серотипами. Как и в случае с вирусом гриппа, используется двойная система классификации, основанная на двух белках на поверхности вируса. гликопротеин VP7 определяет серотипы G, а чувствительный к протеазе белок VP4 определяет серотипы P. Поскольку два гена, которые определяют G-типы и P-типы, могут передаваться потомкам по отдельности, обнаруживаются различные комбинации. Для ротавируса А создана система полногеномного генотипирования, которая используется для определения происхождения атипичных штаммов. Распространенность отдельных G-типов и P-типов варьируется в зависимости от страны и года. Существует по крайней мере 32 типа G и 47 типов P, но при инфекциях людей преобладают лишь несколько комбинаций типов G и P. Это G1P [8], G2P [4], G3P [8], G4P [8], G9P [8] и G12P [8].
Геном ротавирусов состоит из 11 уникальных молекул с двойной спиралью РНК (дцРНК), которые в общей сложности составляют 18 555 нуклеотидов. Каждая спираль или сегмент представляет собой ген , пронумерованный от 1 до 11 в порядке уменьшения размера. Каждый ген кодирует один белок, за исключением генов 9, который кодирует два. РНК окружена трехслойным икосаэдрическим белком капсидом. Вирусные частицы имеют диаметр до 76,5 нм и не имеют оболочки.
 Упрощенная диаграмма расположения структурных белков ротавируса
Упрощенная диаграмма расположения структурных белков ротавируса Существует шесть вирусных белков (ВП), которые образуют вирусную частицу ( вирион ). Эти структурные белки называются VP1, VP2, VP3, VP4, VP6 и VP7. В дополнение к VP существует шесть неструктурных белков (NSP), которые продуцируются только в клетках, инфицированных ротавирусом. Они называются NSP1, NSP2, NSP3, NSP4, NSP5 и NSP6.
. По меньшей мере шесть из двенадцати белков , кодируемых геномом ротавируса, связывают РНК. Роль этих белков в репликации ротавирусов до конца не изучена; их функции, как полагают, связаны с синтезом и упаковкой РНК в вирионе, транспортом мРНК к месту репликации генома, а также трансляцией мРНК и регуляцией экспрессии генов.
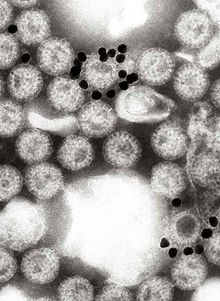 Электронная микрофотография наночастиц золота, прикрепленных к ротавирусу. Маленькие темные круглые объекты представляют собой золотые наночастицы, покрытые моноклональным антителом, специфичным к ротавирусному белку VP6.
Электронная микрофотография наночастиц золота, прикрепленных к ротавирусу. Маленькие темные круглые объекты представляют собой золотые наночастицы, покрытые моноклональным антителом, специфичным к ротавирусному белку VP6. VP1 находится в ядре вирусной частицы и представляет собой РНК-полимеразу фермент. В инфицированной клетке этот фермент производит транскрипты мРНК для синтеза вирусных белков и производит копии сегментов РНК генома ротавируса для вновь продуцируемых вирусных частиц.
VP2 образует сердцевинный слой вириона и связывает геном РНК.
VP3 является частью внутреннего ядра вириона и представляет собой фермент, называемый гуанилилтрансферазой. Это кэпирующий фермент, который катализирует образование 5 'кэпа в посттранскрипционной модификации мРНК. Колпачок стабилизирует вирусную мРНК, защищая ее от разрушающих нуклеиновую кислоту ферментов, называемых нуклеазами..
VP4 находится на поверхности вириона, который выступает в виде иглы. Он связывается с молекулами на поверхности клеток, называемыми рецепторами, и способствует проникновению вируса в клетку. VP4 должен быть преобразован с помощью фермента протеаза трипсина, который находится в кишечнике, в VP5 * и VP8 *, прежде чем вирус станет инфекционным. VP4 определяет, насколько вирулентен вирус, и определяет P-тип вируса. У людей существует связь между группой крови секреторным статусом и восприимчивостью к инфекции. Несекреторы кажутся устойчивыми к инфекциям типов P [4] и P [8], что указывает на то, что антигены группы крови являются рецепторами для этих генотипов.
VP6 составляет основную часть капсида. Он обладает высокой антигенностью и может использоваться для идентификации видов ротавирусов. Этот белок используется в лабораторных тестах на инфекции ротавируса А.
VP7 представляет собой гликопротеин, который формирует внешнюю поверхность вириона. Помимо своих структурных функций, он определяет G-тип штамма и, наряду с VP4, участвует в иммунитете к инфекции.
NSP1, продукт гена 5, представляет собой неструктурный РНК-связывающий белок. NSP1 также блокирует ответ на интерферон, часть врожденной иммунной системы, которая защищает клетки от вирусной инфекции. NSP1 заставляет протеосому деградировать ключевые сигнальные компоненты, необходимые для стимуляции выработки интерферона в инфицированной клетке и для ответа на интерферон, секретируемый соседними клетками. Мишени для разложения включают несколько факторов транскрипции IRF, необходимых для транскрипции гена интерферона.
NSP2 - это РНК-связывающий белок, который накапливается в цитоплазматических включениях (вироплазмах ) и необходим для репликации генома.
NSP3 связан с вирусными мРНК в инфицированных клетках и отвечает за остановку синтеза клеточного белка. NSP3 инактивирует два фактора инициации трансляции, необходимых для синтеза белков из мРНК хозяина. Во-первых, NSP3 выбрасывает поли (A) -связывающий белок (PABP) из фактора инициации трансляции eIF4F. PABP требуется для эффективной трансляции транскриптов с 3 'поли (A) хвостом, который обнаруживается в большинстве транскриптов клетки-хозяина. Во-вторых, NSP3 инактивирует eIF2, стимулируя его фосфорилирование. Для эффективной трансляции мРНК ротавируса, у которой отсутствует 3'-поли (A) хвост, не требуется ни один из этих факторов.
NSP4 - вирусный энтеротоксин, который вызывает диарею и был первым вирусным вирусом. обнаружен энтеротоксин.
NSP5 кодируется сегментом генома 11 ротавируса A. В инфицированных вирусом клетках NSP5 накапливается в вироплазме.
NSP6 является белком, связывающим нуклеиновую кислоту, и кодируется геном 11 из несинфазной открытой рамки считывания.
| РНК-сегмент (ген) | Размер (пар оснований ) | Белок | UniProt | Молекулярный вес кДа | Местоположение | Количество копий на частицу | Функция |
|---|---|---|---|---|---|---|---|
| 1 | 3302 | VP1 | P22678 | 125 | В вершинах ядра | 12 | РНК-зависимая РНК-полимераза |
| 2 | 2690 | VP2 | A2T3R5 | 102 | Образует внутреннюю оболочку ядра | 120 | Связывание РНК |
| 3 | 2591 | VP3 | A2T3S5 | 88 | В вершинах ядра | 12 | фермента, блокирующего мРНК метилтрансферазы |
| 4 | 2362 | VP4 | A2T3T2 | 87 | Поверхностный спайк | 180 | Прикрепление клеток, вирулентность |
| 5 | 1611 | NSP1 | Q99FX5 | 59 | Неструктурное | 0 | связывание 5'РНК, антагонист интерферона |
| 6 | 1356 | VP6 | Q6LE89 | 45 | Внутренний капсид | 780 | Структурные и видоспецифичные антиген |
| 7 | 1104 | NSP3 | P03536 | 37 | Неструктурный | 0 | Повышает активность вирусной мРНК и останавливает синтез клеточного белка |
| 8 | 1059 | NSP2 | A2T3P0 | 35 | Неструктурный | 0 | NTPase участвует в упаковке РНК |
| 9 | 1062 | VP7 VP7 | P03533 | 38 и 34 | Поверхность | 780 | Структурная и нейтрализация антиген |
| 10 | 751 | NSP4 | P04512 | 20 | Неструктурный | 0 | энтеротоксин |
| 11 | 667 | NSP5 NSP6 | A2T3Q9 P11203 | 22 | Неструктурная | 0 | оцРНК и модулятор связывания дцРНК NSP2, фосфопротеин |
Эта таблица основана на обезьяньем ротавирусе штамм SA11. Назначение кодирующих РНК-белков у некоторых штаммов различается.
 Упрощенный рисунок цикла репликации ротавируса. Стадиями являются (1) прикрепление вируса к клеткам-хозяевам, которое опосредуется VP4 и VP7 (2) проникновение вируса в клетку и снятие оболочки вирусного капсида (3) плюс синтез цепочки оцРНК (это действует как мРНК), который опосредуется формированием VP1, VP3 и VP2 (4) вироплазмы, упаковкой вирусной РНК и синтезом минусцепочечной РНК и образованием двухслойных вирусных частиц (5) созреванием вирусных частиц и высвобождением вирионов потомства.
Упрощенный рисунок цикла репликации ротавируса. Стадиями являются (1) прикрепление вируса к клеткам-хозяевам, которое опосредуется VP4 и VP7 (2) проникновение вируса в клетку и снятие оболочки вирусного капсида (3) плюс синтез цепочки оцРНК (это действует как мРНК), который опосредуется формированием VP1, VP3 и VP2 (4) вироплазмы, упаковкой вирусной РНК и синтезом минусцепочечной РНК и образованием двухслойных вирусных частиц (5) созреванием вирусных частиц и высвобождением вирионов потомства. Присоединение вируса к клетке-хозяину инициируется VP4, который прикрепляется к молекулам, называемым гликанами, на поверхности клетки. Вирус проникает в клетки посредством рецепторно-опосредованного эндоцитоза и формирует везикулу, известную как эндосома. Белки в третьем слое (VP7 и шип VP4) разрушают мембрану эндосомы, создавая разницу в концентрации кальция. Это вызывает расщепление тримеров VP7 на отдельные белковые субъединицы, оставляя белковые оболочки VP2 и VP6 вокруг вирусной дцРНК, образуя двухслойную частицу (DLP).
Одиннадцать цепей дцРНК остаются под защитой двух белковых оболочек, а вирусная РНК-зависимая РНК-полимераза создает транскрипты мРНК двухцепочечного вирусного генома. Оставаясь в ядре, вирусная РНК уклоняется от врожденных иммунных ответов хозяина, включая РНК-интерференцию, которые запускаются присутствием двухцепочечной РНК.
Во время инфекции ротавирусы продуцируют мРНК для обоих биосинтез белка и репликация гена. Большинство ротавирусных белков накапливаются в вироплазме, где реплицируется РНК и собираются DLP. В вироплазме вирусные РНК с положительным смыслом, которые используются в качестве матриц для синтеза вирусной геномной дцРНК, защищены от индуцированной миРНК деградации РНКазы. Вироплазма образуется вокруг ядра клетки уже через два часа после заражения вирусом и состоит из вирусных фабрик, которые, как считается, состоят из двух вирусных неструктурных белков: NSP5 и NSP2. Ингибирование NSP5 посредством РНК-интерференции in vitro приводит к резкому снижению репликации ротавируса. DLP мигрируют в эндоплазматический ретикулум, где они получают свой третий внешний слой (образованный VP7 и VP4). Вирусы потомства высвобождаются из клетки в результате лизиса.
 Ротавирусы в фекалиях инфицированного ребенка
Ротавирусы в фекалиях инфицированного ребенка Ротавирусы передаются через фекально-оральный путь, через контакт с загрязненными руками, поверхностями и предметами и, возможно, через дыхательный путь. Вирусная диарея очень заразна. Фекалии инфицированного человека могут содержать более 10 триллионов инфекционных частиц на грамм; менее 100 из них необходимы для передачи инфекции другому человеку.
Ротавирусы стабильны в окружающей среде и были обнаружены в лимане проб на уровне до 1–5 инфекционных частиц на США галлон. Вирусы выживают от 9 до 19 дней. Санитарные меры, необходимые для уничтожения бактерий и паразитов, кажутся неэффективными в борьбе с ротавирусом, поскольку частота случаев ротавирусной инфекции в странах с высокими и низкими стандартами здравоохранения одинакова.
Ротавирусный энтерит - заболевание от легкой до тяжелой степени, которое характеризуется тошнотой, рвотой, водянистой диареей и субфебрильной лихорадкой. После заражения ребенка вирусом проходит инкубационный период около двух дней до появления симптомов. Период болезни острый. Симптомы часто начинаются с рвоты, за которой следует от четырех до восьми дней обильной диареи. Обезвоживание чаще встречается при ротавирусной инфекции, чем при большинстве инфекций, вызванных бактериальными патогенами, и является наиболее частой причиной смерти, связанной с ротавирусной инфекцией.
Ротавирусная инфекция может возникать в течение всей жизни: первое обычно вызывает симптомы, но последующие инфекции обычно легкие или бессимптомные, поскольку иммунная система обеспечивает некоторую защиту. Следовательно, частота симптоматических инфекций наиболее высока у детей в возрасте до двух лет и постепенно снижается к 45 годам. Наиболее серьезные симптомы, как правило, возникают у детей от шести месяцев до двух лет, пожилых людей и людей с иммунодефицитом. Из-за иммунитета, приобретенного в детстве, большинство взрослых не восприимчивы к ротавирусу; гастроэнтерит у взрослых обычно имеет другую причину, а не ротавирус, но бессимптомные инфекции у взрослых могут поддерживать передачу инфекции в обществе. Есть некоторые свидетельства того, что секреторный статус группы крови и преобладающие бактерии в кишечнике могут влиять на восприимчивость к инфекции ротавирусами.
 Электронная микрофотография энтероцита, инфицированного ротавирусом (вверху), по сравнению с незараженная ячейка (внизу). Планка = прибл. 500 нм
Электронная микрофотография энтероцита, инфицированного ротавирусом (вверху), по сравнению с незараженная ячейка (внизу). Планка = прибл. 500 нм Ротавирусы реплицируются в основном в кишечнике и инфицируют энтероциты ворсинок тонкой кишки, что приводит к структурным и функциональным изменениям эпителий. Имеются данные о внекишечном распространении инфекционного вируса на другие органы и макрофаги на людях, особенно на животных.
Диарея вызвана множественной активностью вируса. Мальабсорбция возникает из-за разрушение клеток кишечника, называемых энтероцитами. токсичный ротавирусный белок NSP4 индуцирует возрастную и кальций ион-зависимую секрецию хлорида, нарушает SGLT1 (котранспортер натрия / глюкозы). 2) опосредованная переносчиком реабсорбция воды, очевидно, снижает активность мембраны щеточной каймы дисахаридаз и активирует кальций-зависимую секреторные рефлексы кишечной нервной системы. Повышенные концентрации ионов кальция в цитозоле (которые необходимы для сборки потомства вирусов) достигаются за счет действия NSP4 как виропорин. Это увеличение ионов кальция приводит к аутофагии (самоуничтожению) инфицированных энтероцитов.
NSP4 также секретируется. Эта внеклеточная форма, которая модифицируется протеазными ферментами в кишечнике, представляет собой энтеротоксин, который действует на неинфицированные клетки через рецепторы интегрина, которые, в свою очередь, вызывают и повышают внутриклеточные концентрации ионов кальция, секреторная диарея и аутофагия.
Рвота, характерная для ротавирусного энтерита, вызывается вирусом, поражающим энтерохромаффинные клетки слизистой оболочки пищеварительного тракта. Инфекция стимулирует выработку 5'-гидрокситриптамина (серотонин ). Это активирует афферентные нервы блуждающего нерва, что, в свою очередь, активирует клетки ствола головного мозга, контролирующие рвотный рефлекс.
Здоровые энтероциты секретируют лактазу в тонкий кишечник; непереносимость молока из-за лактазной недостаточности - симптом ротавирусной инфекции, которая может сохраняться в течение нескольких недель. Рецидив легкой диареи часто возникает после повторного включения молока в рацион ребенка из-за бактериальной ферментации дисахарида лактозы в кишечнике.
Ротавирусы вызывают иммунные ответы как В, так и Т-клеток. Антитела к белкам ротавируса VP4 и VP7 нейтрализуют вирусную инфекционность in vitro и in vivo. Вырабатываются специфические антитела классов IgM, IgA и IgG, которые, как было показано, защищают от ротавирусной инфекции за счет пассивного переноса антител другим животным. Материнский транс-плацентарный IgG может играть роль в защите новорожденных от ротавирусных инфекций, но, с другой стороны, может снижать эффективность вакцины.
После заражения ротавирусами происходит быстрое врожденное иммунный ответ с участием типов I и III интерферонов и других цитокинов (в частности, Th1 и Tdiv class="ht"), которые ингибируют репликацию вируса и привлекают макрофаги и естественные клетки-киллеры в инфицированные ротавирусом клетки. ДцРНК ротавируса активирует рецепторы распознавания образов, такие как toll-подобные рецепторы, которые стимулируют выработку интерферонов. Белок ротавируса NSP1 противодействует воздействию интерферонов 1 типа, подавляя активность регуляторных белков интерферона IRF3, IRF5 и IRF7.
Уровни IgG и IgA в крови и IgA в кишечнике коррелируют с защитой от инфекции. Было заявлено, что специфические для ротавируса сывороточные IgG и IgA с высокими титрами (например,>1: 200) обладают защитным действием, и существует значительная корреляция между титрами IgA и эффективностью ротавирусной вакцины.
Диагностика ротавирусной инфекции обычно следует после диагностики гастроэнтерита как причины тяжелой диареи. Большинство детей, поступающих в больницу с гастроэнтеритом, проходят тестирование на ротавирус A. Специфический диагноз инфекции ротавирусом A ставится при обнаружении вируса в стуле ребенка с помощью иммуноферментного анализа. На рынке имеется несколько лицензированных наборов тестов, которые являются чувствительными, специфичными и выявляют все серотипы ротавируса А. Другие методы, такие как электронная микроскопия и ПЦР (полимеразная цепная реакция), являются используется в исследовательских лабораториях. Полимеразная цепная реакция с обратной транскрипцией (ОТ-ПЦР ) может обнаруживать и идентифицировать все виды и серотипы ротавирусов человека.
Лечение острой ротавирусной инфекции - это неспецифический и включает лечение симптомов и, самое главное, лечение обезвоживания. При отсутствии лечения дети могут умереть от серьезного обезвоживания. В зависимости от тяжести диареи лечение состоит из пероральной регидратационной терапии, во время которой ребенку дают пить воду, содержащую определенное количество соли и сахара. В 2004 году Всемирная организация здравоохранения (ВОЗ) и ЮНИСЕФ рекомендовали использование низкоосмолярного раствора для пероральной регидратации и добавки цинка в качестве двустороннего лечения острой диареи. Некоторые инфекции достаточно серьезны, чтобы потребовать госпитализации, когда жидкости вводятся с помощью внутривенной терапии или назогастральной интубации, а у ребенка электролиты и уровень сахара в крови контролируются. Ротавирусные инфекции редко вызывают другие осложнения, и для хорошо воспитанного ребенка прогноз отличный. Было показано, что пробиотики сокращают продолжительность ротавирусной диареи, и, по данным Европейского общества детской гастроэнтерологии, «эффективные вмешательства включают введение специфические пробиотики, такие как Lactobacillus rhamnosus или Saccharomyces boulardii, диосмектит или рацекадотрил."
Ротавирусы очень заразны и не могут лечиться антибиотиками или другими лекарствами. Поскольку улучшение санитарии не снижает распространенность ротавирусной болезни, а уровень госпитализаций остается высоким, несмотря на использование пероральных регидратирующих препаратов, основным вмешательством общественного здравоохранения является вакцинация. В 1998 г. ротавирусная вакцина была лицензирована для использования в Соединенных Штатах. Клинические испытания в США, Финляндии и Венесуэле показали, что она эффективна от 80 до 100% для предотвращения При тяжелой диарее, вызванной ротавирусом А, исследователи не обнаружили статистически значимых серьезных побочных эффектов. Однако производитель снял ее с рынка в 1999 году после того, как было обнаружено, что вакцина могла способствовать повышенному риску инвагинации, типа непроходимости кишечника, в одном из каждых 12000 вакцинированных младенцев. Этот опыт вызвал ожесточенные дискуссии об относительных рисках и преимуществах ротавирусной вакцины. В 2006 году было показано, что две новые вакцины против ротавирусной инфекции А безопасны и эффективны для детей, а в 2009 году ВОЗ рекомендовала включить ротавирусную вакцину во все национальные программы иммунизации.
Заболеваемость и тяжесть ротавируса. значительно снизилось количество инфекций в странах, которые следовали этой рекомендации. Обзор имеющихся данных клинических испытаний, проведенных в 2014 году в странах, регулярно использующих ротавирусные вакцины в своих национальных программах иммунизации, показал, что ротавирусные вакцины снизили количество госпитализаций, связанных с ротавирусной инфекцией, на 49–92 процентов и все они вызывают госпитализации по причине диареи на 17–55 процентов. В Мексике, которая в 2006 году была одной из первых стран в мире, внедривших ротавирусную вакцину, уровень смертности от диарейных болезней снизился в течение сезона 2009 года более чем на 65 процентов среди детей в возрасте до двух лет. В Никарагуа, которая в 2006 году стала первой развивающейся страной, внедрившей ротавирусную вакцину, количество тяжелых ротавирусных инфекций сократилось на 40 процентов, а количество обращений за неотложной помощью - наполовину. В Соединенных Штатах вакцинация против ротавируса с 2006 г. привела к снижению числа госпитализаций, связанных с ротавирусами, на целых 86 процентов. Вакцины также могли предотвратить болезнь у непривитых детей, ограничивая количество циркулирующих инфекций. В развивающихся странах Африки и Азии, где происходит большинство случаев смерти от ротавирусов, большое количество испытаний безопасности и эффективности, а также недавние исследования воздействия и эффективности Rotarix и RotaTeq после внедрения показали, что вакцины резко снижают количество тяжелых заболеваний среди младенцев. В сентябре 2013 года вакцина была предложена всем детям в Великобритании в возрасте от двух до трех месяцев, и ожидается, что она сократит вдвое случаи тяжелой инфекции и снизит количество детей, попадающих в больницу из-за инфекции, на 70 процентов. В Европе частота госпитализаций после заражения ротавирусами снизилась на 65–84% после введения вакцины. В глобальном масштабе вакцинация позволила снизить количество госпитализаций и посещений отделений неотложной помощи в среднем на 67%.
Ротавирусные вакцины лицензированы более чем в 100 странах, и более 80 стран ввели плановую вакцинацию против ротавируса, почти половина при поддержке Гави, Альянс вакцин. Сделать ротавирусные вакцины доступными, доступными и доступными по цене во всех странах - особенно в странах с низким и средним уровнем доходов в Африке и Азии, где происходит большинство смертей от ротавируса, PATH (бывшая Программа соответствующих технологий в здравоохранении), ВОЗ, Центры по контролю и профилактике заболеваний США и Гави установили партнерские отношения с исследовательскими учреждениями и правительствами для сбора и распространения доказательств, снижения цен и ускорения внедрения.
Вакцина может предотвращение диабета 1 типа.
 Сезонная изменчивость ротавирусной инфекции в Англии: пик заболеваемости в зимние месяцы.
Сезонная изменчивость ротавирусной инфекции в Англии: пик заболеваемости в зимние месяцы.  Предотвратимая детская смертность от ротавирусной вакцинации, 2016 год. Ежегодное количество предотвратимых смертей у детей младше пяти лет от ротавируса, если был достигнут полный охват ротавирусной вакциной.
Предотвратимая детская смертность от ротавирусной вакцинации, 2016 год. Ежегодное количество предотвратимых смертей у детей младше пяти лет от ротавируса, если был достигнут полный охват ротавирусной вакциной. Ротавирус А, на который приходится более 90% ротавирусных гастроэнтеритов у людей, эндемичен во всем мире. Ежегодно ротавирусы вызывают миллионы случаев диареи в развивающихся странах, почти 2 миллиона из которых приводят к госпитализации. По оценкам, в 2013 году от ротавирусных инфекций умерло 215 000 детей младше пяти лет, 90 процентов из которых проживали в развивающихся странах. Почти каждый ребенок инфицирован ротавирусами к пяти годам. Ротавирусы являются ведущей единственной причиной тяжелой диареи у младенцев и детей, на нее приходится около трети случаев, требующих госпитализации, и на нее приходится 37% смертей, связанных с диареей, и 5% всех смертей у детей младше пяти лет. Мальчики в два раза чаще, чем девочки, попадают в больницу по поводу ротавирусной инфекции. В эпоху до вакцинации ротавирусные инфекции возникали в основном в прохладное и засушливое время года. Число случаев заражения пищевых продуктов неизвестно.
Вспышки ротавируса Диарея часто встречается среди госпитализированных младенцев, маленьких детей, посещающих детские сады, и пожилых людей в домах престарелых. Вспышка заболевания, вызванная загрязненной городской водой, произошла в Колорадо в 1981 году. В 2005 году самая крупная зарегистрированная эпидемия диареи произошла в Никарагуа. Эта необычно крупная и серьезная вспышка была связана с мутациями в геноме ротавируса А, что, возможно, помогло вирусу избежать преобладающего иммунитета среди населения. Подобная крупная вспышка произошла в Бразилии в 1977 году.
Ротавирус B, также называемый ротавирусом диареи взрослых или ADRV, вызвал серьезные эпидемии тяжелой диареи, поразившие тысячи людей всех возрастов в Китае. Эти эпидемии возникли в результате загрязнения сточными водами питьевой воды. Инфекции ротавирусом B также произошли в Индии в 1998 году; причинный штамм был назван CAL. В отличие от ADRV, штамм CAL является эндемичным. На сегодняшний день эпидемии, вызванные ротавирусом B, ограничиваются материковым Китаем, и исследования указывают на отсутствие иммунитета к этому виду в Соединенных Штатах. Ротавирус C был связан с редкими и спорадическими случаями диареи у детей, и небольшие вспышки произошли в семьях.
Ротавирусы заражают детенышей многих видов животных, и они являются основная причина диареи у диких и разводимых животных во всем мире. В качестве патогена домашнего скота, особенно молодых телят и поросят, ротавирусы причиняют фермерам экономические потери из-за затрат на лечение, связанных с высокими показателями заболеваемости и смертности. Эти ротавирусы являются потенциальным резервуаром для генетического обмена с ротавирусами человека. Существуют доказательства того, что ротавирусы животных могут инфицировать людей либо путем прямой передачи вируса, либо путем внесения одного или нескольких сегментов РНК в реассортанты с человеческими штаммами.
 Один из Флюеттов. оригинальные электронные микрофотографии, показывающие одну частицу ротавируса. При исследовании с помощью электронной микроскопии с отрицательным окрашиванием ротавирусы часто напоминают колеса.
Один из Флюеттов. оригинальные электронные микрофотографии, показывающие одну частицу ротавируса. При исследовании с помощью электронной микроскопии с отрицательным окрашиванием ротавирусы часто напоминают колеса. В 1943 году Джейкоб Лайт и Гораций Ходс доказали, что фильтруемый агент в фекалиях детей с инфекционной диареей также вызывает у крупного рогатого скота понос (диарею домашнего скота). Спустя три десятилетия было показано, что сохранившиеся образцы возбудителя являются ротавирусом. В последующие годы было показано, что вирус у мышей связан с вирусом, вызывающим чистки. В 1973 году Рут Бишоп и его коллеги описали родственные вирусы, обнаруженные у детей с гастроэнтеритом.
В 1974 году Томас Генри Флюетт предложил название ротавирус после того, как заметил это при просмотре через электронный микроскоп частица ротавируса выглядит как колесо (rota на латыни). Это название было официально признано Международным комитетом по таксономии вирусов четыре года спустя. В 1976 году родственные вирусы были описаны у нескольких других видов животных. Эти вирусы, вызывающие острый гастроэнтерит, были признаны коллективным патогеном, поражающим людей и других животных во всем мире. Серотипы ротавирусов были впервые описаны в 1980 году, а в следующем году ротавирусы от людей были впервые выращены в культурах клеток, полученных из почек обезьян, путем добавления трипсина (фермент, обнаруженный в двенадцатиперстной кишки млекопитающих и теперь известно, что он необходим для репликации ротавируса) в культуральную среду. Возможность выращивать ротавирусы в культуре ускорила темпы исследований, и к середине 1980-х годов были оценены первые вакцины-кандидаты.
| Классификация | D |
|---|---|
| Внешние ресурсы |
| Викискладе есть медиафайлы, связанные с ротавирусом. |