 Репликация по вращающемуся кругу создает несколько копий одного кругового шаблона.
Репликация по вращающемуся кругу создает несколько копий одного кругового шаблона. Репликация с вращающимся кругом (RCA ) представляет собой процесс однонаправленной репликации нуклеиновой кислоты, который может быстро синтезировать несколько копий кольцевых молекул ДНК или РНК, таких как плазмиды, геномы бактериофагов и геном кольцевой РНК вироидов. Некоторые эукариотические вирусы также реплицируют свою ДНК или РНК через механизм катящегося круга.
В качестве упрощенной версии естественного катящегося круга репликации был разработан метод изотермической амплификации ДНК, амплификация по катящемуся кругу. Механизм RCA широко используется в молекулярной биологии и биомедицинской нанотехнологии, особенно в области биосенсинга (как метода усиления сигнала).
 Иллюстрация репликации катящегося круга.
Иллюстрация репликации катящегося круга. Катящийся круг Репликация ДНК инициируется белком-инициатором, кодируемым плазмидной или бактериофаговой ДНК, который разрывает одну цепь двухцепочечной кольцевой молекулы ДНК в месте, называемом двухцепочечным ориджином, или DSO. Белок-инициатор остается связанным с 5'-фосфатным концом разорванной цепи, а свободный 3'-гидроксильный конец высвобождается, чтобы служить праймером для синтеза ДНК с помощью ДНК-полимеразы III. Используя неотмеченную цепь в качестве матрицы, репликация происходит вокруг кольцевой молекулы ДНК, вытесняя разорванную цепь как одноцепочечную ДНК. Смещение разорванной цепи осуществляется кодируемой хозяином геликазой, называемой PcrA (сокращение от сокращенной копии плазмиды) в присутствии белка инициации репликации плазмиды.
Непрерывный синтез ДНК может давать множественные одноцепочечные линейные копии исходной ДНК в непрерывной серии от головы к хвосту, называемой конкатемером. Эти линейные копии могут быть преобразованы в двухцепочечные кольцевые молекулы посредством следующего процесса:
Во-первых, белок-инициатор делает еще один разрыв в ДНК, чтобы остановить синтез первой (ведущей) цепи. РНК-полимераза и ДНК-полимераза III затем реплицируют одноцепочечную исходную ДНК (SSO) с образованием другого двухцепочечного круга. ДНК-полимераза I удаляет праймер, заменяя его ДНК, и ДНК-лигаза соединяет концы с образованием другой молекулы двухцепочечной кольцевой ДНК.
Вкратце, типичная репликация катящегося круга ДНК состоит из пяти этапов:
Некоторые ДНК-вирусы реплицируют свою геномную информацию в клетках-хозяевах через катящийся круг репликация. Например, вирус герпеса-6 (HHV-6) (hibv) экспрессирует набор «ранних генов», которые, как считается, участвуют в этом процессе. Образующиеся длинные конкатемеры впоследствии расщепляются между областями pac-1 и pac-2 генома HHV-6 с помощью рибозимов, когда они упаковываются в отдельные вирионы.
 Модель для репликации по катящемуся кругу HPV16.
Модель для репликации по катящемуся кругу HPV16. Вирус папилломы человека-16 (HPV-16) представляет собой другой вирус, который использует циклическую репликацию для получения потомства с высокой скоростью. ВПЧ-16 инфицирует эпителиальные клетки человека и имеет двухцепочечный кольцевой геном. Во время репликации в ориджине гексамер E1 оборачивается вокруг однонитевой ДНК и перемещается в направлении от 3 'до 5'. При нормальной двунаправленной репликации два репликационных белка диссоциируют во время столкновения, но в HPV-16 считается, что гексамер E1 не диссоциирует, что приводит к непрерывной катящейся репликации. Считается, что этот механизм репликации ВПЧ может иметь физиологические последствия для интеграции вируса в хромосому хозяина и возможного развития рака шейки матки.
Кроме того, геминивирус также использует катящийся круг репликация как механизм репликации. Это вирус, ответственный за уничтожение многих основных сельскохозяйственных культур, таких как маниока, хлопок, бобовые, кукуруза, томаты и окра. Вирус имеет кольцевую одноцепочечную ДНК, которая реплицируется в клетках растения-хозяина. Весь процесс инициируется геминивирусным белком-инициатором репликации Rep, который также отвечает за изменение среды хозяина, чтобы действовать как часть механизма репликации. Rep также поразительно сходен с большинством других белков инициаторов катящейся репликации эубактерий с наличием мотивов I, II и III на N-конце. Во время репликации по методу катящегося круга оцДНК геминивируса превращается в дцДНК, и Rep затем присоединяется к дцДНК в исходной последовательности TAATATTAC. После того, как Rep, вместе с другими белками репликации, связывается с дцДНК, он образует стволовую петлю, где ДНК затем расщепляется по наномерной последовательности, вызывая смещение цепи. Это смещение позволяет репликационной вилке продвигаться в направлении от 3 'до 5', что в конечном итоге дает новую цепь оцДНК и конкатамерную цепь ДНК.
Бактериофаг T4 Промежуточные продукты репликации ДНК включают кольцевые и разветвленные круговые конкатемерные структуры. Эти структуры, вероятно, отражают механизм репликации катящегося круга.
Некоторые РНК-вирусы и вироиды также реплицируют свой геном посредством репликации РНК по катящемуся кругу. Для вироидов существует два альтернативных пути репликации РНК, за которыми, соответственно, следуют члены семейства Pospivirodae (асимметричная репликация) и Avsunviroidae (симметричная репликация).
 Репликация вирусной РНК по катящемуся кругу
Репликация вирусной РНК по катящемуся кругу В семействе Pospiviroidae (PSTVd-like) кольцевая плюс-цепь РНК транскрибируется с помощью РНК-полимеразы хозяина в олигомерные минус-цепи, а затем в олигомерные плюс-цепи. Эти олигомерные плюс-цепи расщепляются хозяйской РНКазой и лигируются хозяйской РНК-лигазой для преобразования мономерной плюс-цепи кольцевой РНК. Это называется асимметричным путем репликации по катящемуся кругу. Вироиды семейства Avsunviroidae (ASBVd-подобные) реплицируют свой геном посредством симметричного пути репликации по катящемуся кругу. В этом симметричном пути олигомерные минус-цепи сначала расщепляются и лигируются с образованием мономерных минус-цепей, а затем транскрибируются в олигомерные плюс-цепи. Эти олигомерные плюс-цепи затем отщепляются и лигируются для преобразования мономерной плюс-цепи. Симметричный путь репликации был назван потому, что как положительные, так и отрицательные цепи образуются одинаково.
Расщепление олигомерных плюс и минус цепей опосредуется саморасщепляющейся структурой рибозима «головка молотка», присутствующей в Avsunviroidae, но такая структура отсутствует у Pospiviroidae.
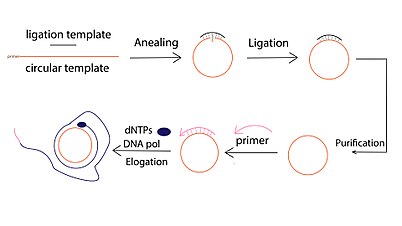 Молекулярный механизм амплификации по катящемуся кругу (RCA)
Молекулярный механизм амплификации по катящемуся кругу (RCA) Производная форма репликации по катящемуся кругу была успешно использована для амплификации ДНК из очень небольших количеств исходного материала. Этот метод усиления называется усилением по скользящему кругу (RCA). В отличие от традиционных методов амплификации ДНК, таких как полимеразная цепная реакция (ПЦР), RCA - это метод изотермической амплификации нуклеиновых кислот, при котором полимераза непрерывно добавляет отдельные нуклеотиды к праймеру, отожженному к кольцевой матрице в результате получается длинная конкатемерная оцДНК, содержащая от десятков до сотен тандемных повторов (комплементарных кольцевой матрице).
Для проведения реакции RCA требуются пять важных компонентов:
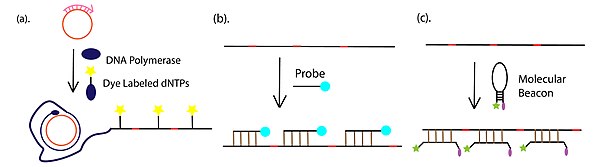 методы обнаружения продукта RCA
методы обнаружения продукта RCA Полимеразы, используемые в RCA: Phi29, Bst и Vent exo- ДНК-полимераза для амплификации ДНК и T7 РНК-полимераза для амплификации РНК. Поскольку ДНК-полимераза Phi29 имеет лучшую процессивность и способность замещения цепи среди всех вышеупомянутых полимераз, она наиболее часто использовалась в реакциях RCA. В отличие от полимеразной цепной реакции (ПЦР), RCA можно проводить при постоянной температуре (от комнатной температуры до 65 ° C) как в свободном растворе, так и на иммобилизованных мишенях (твердофазная амплификация).
Обычно реакция RCA на ДНК включает три этапа:
RCA производит линейную амплификацию ДНК, поскольку каждая круглая матрица растет с заданной скоростью на определенное количество времени. Для увеличения выхода и достижения экспоненциальной амплификации, как это делает ПЦР, было исследовано несколько подходов. Одним из них является амплификация с гиперразветвленным катящимся кругом или HRCA, когда добавляются и удлиняются праймеры, которые отжигаются с исходными продуктами RCA. Таким образом, исходный RCA создает больше шаблонов, которые можно усилить. Другой вариант - амплификация по кругу или C2CA, где продукты RCA перевариваются рестрикционным ферментом и лигируются в новые кольцевые матрицы с использованием рестрикционного олигонуклеотида, за которым следует новый цикл RCA с большим количеством кольцевых матриц для амплификации.
 иллюстрация иммуно-RCA
иллюстрация иммуно-RCA RCA может усилить единичное событие молекулярного связывания более чем в тысячу раз, что делает его особенно полезным для обнаружения мишеней со сверхнизким содержанием. Реакции RCA могут проводиться не только в среде свободного раствора, но и на твердой поверхности, такой как стекло, микрошарики или наночастицы, микропланшеты, микрофлюидные устройства или даже бумажные полоски. Эта особенность делает его очень мощным инструментом для усиления сигналов в твердофазных иммуноанализах (например, ELISA ). Таким образом, RCA становится универсальным инструментом для усиления сигнала с широким спектром приложений в геномике, протеомике, диагностике и биодатчиках.
Immuno-RCA - это метод изотермического усиления сигнала для высокоспецифичного и высокочувствительного обнаружения и количественного определения белков. Этот метод объединяет два поля: RCA, который позволяет амплификацию нуклеотидов, и иммуноанализ, в котором используются антитела, специфичные к внутриклеточным или свободным биомаркерам. В результате иммуно-RCA дает специфический усиленный сигнал (высокое отношение сигнал / шум), что делает его пригодным для обнаружения, количественной оценки и визуализации протеиновых маркеров с низким содержанием в жидкофазных иммуноанализах и иммуногистохимии.
Иммуно- RCA следует типичной иммуноабсорбирующей реакции при окрашивании тканей методом ELISA или иммуногистохимии. Детектирующие антитела, используемые в реакции иммуно-RCA, модифицируются путем присоединения олигонуклеотида оцДНК к концу тяжелых цепей. Таким образом, участок Fab (фрагмент, связывание антигена) детектирующего антитела все еще может связываться со специфическими антигенами, а олигонуклеотид может служить праймером для реакции RCA.
Типичная процедура иммуно-RCA, опосредованная антителами, следующая:
 Иллюстрация иммуно-RCA на основе аптамера
Иллюстрация иммуно-RCA на основе аптамера 1. Детектирующее антитело распознает конкретную белковую мишень. Это антитело также прикреплено к олигонуклеотидному праймеру.
2. Когда присутствует кольцевая ДНК, она отжигается, и праймер совпадает с комплементарной последовательностью кольцевой ДНК.
3. Комплементарная последовательность кольцевой ДНК-матрицы копируется сотни раз и остается прикрепленной к антителу.
4. Выход RCA (удлиненная оцДНК) обнаруживается с помощью флуоресцентных зондов с использованием флуоресцентного микроскопа или считывающего устройства для микропланшетов.
Помимо опосредованной антителами иммуно-RCA, праймер RCA оцДНК также может быть конъюгирован с 3'-концом аптамера ДНК. Хвост праймера можно амплифицировать с помощью амплификации по катящемуся кругу. Продукт можно визуализировать по маркировке флуоресцентного репортера. Процесс показан на рисунке справа.
Различные производные RCA широко использовались в области биодатчика. Например, RCA успешно используется для обнаружения наличия вирусной и бактериальной ДНК из клинических образцов, что очень полезно для быстрой диагностики инфекционных заболеваний. Он также использовался в качестве метода усиления сигнала на чипе для нуклеиновых кислот (как для ДНК, так и для РНК) микроматрицы анализа.
В дополнение к функции амплификации в приложениях биодатчика, метод RCA может применяться для создания наноструктур ДНК, а также гидрогелей ДНК . Продукты RCA также можно использовать в качестве шаблонов для периодической сборки наноразмеров или белков, синтеза металлических нанопроволок и образования наноостровков.